
【题目】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
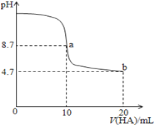
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.b点所示溶液中c(A-)> c(HA)
C.a、b两点所示溶液中水的电离程度相同
D.pH=7时,c(Na+)= c(A-)+ c(HA)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。
(1)铜元素基态原子的价电子排布式为_______,其核外能级能量的高低3d______4s(填“>”、“<”或“=”)
(2)Cu与元素A能形成如下图所示的两种化合物甲和乙。元素A是短周期非金属元素,A的常见氧化物常温下为液态,其熔沸点比同主族其他元素的氧化物高。
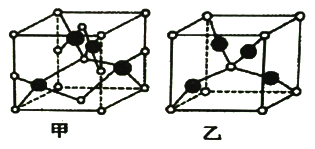
① 两种化合物的化学式分别为:甲___________,乙___________。
② 热稳定性甲_________乙(填“>”、“<”或“=”),试从原子结构上解释原因____。
(3)铜离子形成的某种配合物阳离子具有轴向狭长的八面体结构(如下图)。
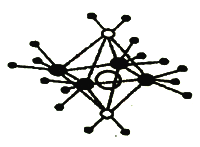
已知两种配体都是10电子的中性分子,且都含氢元素。
① 两种配体分子的配位原子电负性大小为______(填元素符号),其中热稳定性较弱的配体为(用电子式表示)__________。
② 该配合物阳离子与SO42-形成的配合物X的化学式为_________.
(4)Cu单质的晶体为面心立方堆积,其晶胞立方体的边长为acm, Cu的相对原子质量为63.5,单质Cu的密度为ρg/cm3,则阿伏加德罗常数可表示为_____mol-1(含“a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
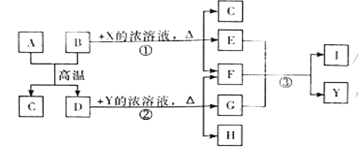
请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应1的化学方程式为 。
(3)19.2g的D与足量的一定浓度X的溶液反应,将所得到的气体与 LO2(标准状况下)混合,恰好能被水完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中依次通入过量的下列气体,第一次无沉淀,第二次有沉淀的组合是
选项 | A | B | C | D |
第一次 | CO2 | NO | NO2 | SO2 |
第二次 | SO2 | CO2 | CO2 | NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为_______________;产物中阳离子的配体是_____________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com