
【题目】下列物质中所含微粒的个数比是1∶1的是( )
A. CH3COONa溶液中CH3COO-和Na+
B. NH4+中的质子和电子
C. Na2O2固体中阴、阳离子
D. ![]() 原子中的质子和中子
原子中的质子和中子
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关叙述中不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH<7
B. 沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
C. 在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,则NH3H2O电离被抑制,溶液pH减少
D. 0.1mol L-1的HA溶液pH=1,该溶液中由水电离的c(OH-)=l×10-13mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法可用于治理亚硝酸盐对水体的污染,模拟工艺如图所示,下列说法不正确的是
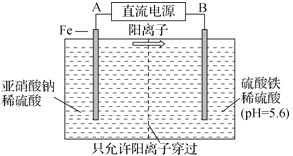
A. A、B分别为直流电源的正极和负极
B. 当电解过程转移0.6mol电子时,左侧区域质量减少1.4g
C. 电解过程中,左侧区域将依次发生反应为:Fe-2e-=Fe2+ 、2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O
D. 研究表明,当右侧区域pH较小时,会有气体逸出,该现象说明H+的氧化性强弱与其c(H+)有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO2气体,另一个盛有O2和N2的混和气体,则两容器内的气体一定具有相同的( )
A.密度B.原子数C.质量D.分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要480mL 0.5mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH的质量______g,应选用容量瓶的规格是_______mL。
(2)除容量瓶外还需要的其它玻璃仪器是________、________及玻璃棒
(3)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)________。
A 将容量瓶盖紧,振荡,摇匀
B 用托盘天平准确称量所需的NaOH质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C 用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
D 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E 将已冷却的溶液沿玻璃棒注入容量瓶中
F 继续往容量瓶内小心加水,直到液面接近刻度1-2cm 处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)没有进行C操作________;配制溶液时,定容时仰视刻度线 ________;容量瓶未干燥________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
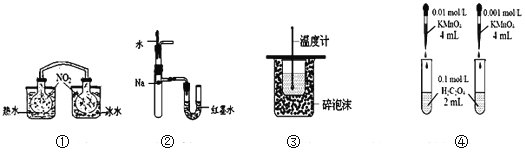
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 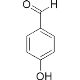 的熔沸点明显高于
的熔沸点明显高于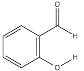 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂A应为_______ 。
(2)写出实验③中I-反应的离子方程式___________。
(3)对比实验②③④,可以得出的结论是__________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2。
ii.pH>9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示:
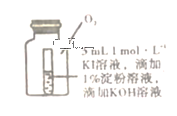
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是________(填序号)。
A.既发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B.既发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C.发生了氧化反应,但没有发生歧化反应
D.发生了歧化反应,但没有发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
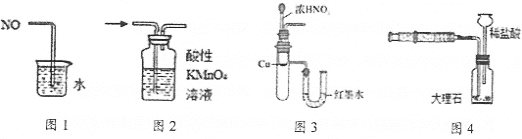
A.图1可用于吸收多余的NO
B.图2可用于检验SO2的漂白性
C.图3可用于说明铜与浓硝酸反应的能量变化
D.图4可用于测定CO2的生成速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com