
【题目】25℃时,下列有关叙述中不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH<7
B. 沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
C. 在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,则NH3H2O电离被抑制,溶液pH减少
D. 0.1mol L-1的HA溶液pH=1,该溶液中由水电离的c(OH-)=l×10-13mol·L-1
【答案】B
【解析】
A.pH=13的NaOH溶液中氢氧化钠的浓度为0.1mol/L,pH=1的醋酸溶液中醋酸的浓度大于0.1mol/L,若两溶液等体积混合后醋酸过量,所得溶液呈酸性,溶液的pH<7,A项正确;
B. 硫酸钡在熔融状态下能够完全电离出阴阳离子,且在水溶液中虽然其溶度积常数很小,但只要溶解的部分就完全电离,所以硫酸钡是强电解质,B项错误;
C. NH3·H2O![]() NH4++OH-;加入氯化铵晶体,铵根离子浓度变大,NH3·H2O的电离平衡向逆向移动,电离程度减小,溶液pH值减小,C项正确;
NH4++OH-;加入氯化铵晶体,铵根离子浓度变大,NH3·H2O的电离平衡向逆向移动,电离程度减小,溶液pH值减小,C项正确;
D. 0.1mol L-1的HA溶液pH=1,则溶液中的c(H+)=0.1 mol L-1,Kw=c(H+)×c(OH-)=10-14,则该酸溶液中由水电离出的c(OH-)=![]() =l×10-13 mol·L-1,D项正确;
=l×10-13 mol·L-1,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
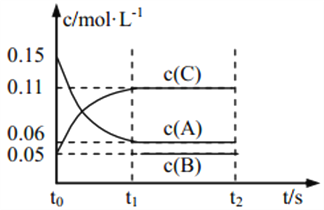
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子交换法回收钒的新工艺,回收率达到91.7%。部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如图所示:
![]()
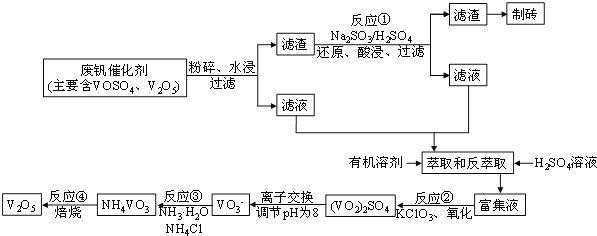
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示____________,用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是________
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为_________________________
(3)若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O===3(VO2)2SO4+KCl+3H2SO4。若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12︰7,则废钒催化剂中VOSO4 和V2O5的物质的量之比为_____
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式_
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为:_________________
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O![]() V2++VO2++2H+
V2++VO2++2H+
①放电时的正极反应为_______________________
②充电时的阴极反应为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
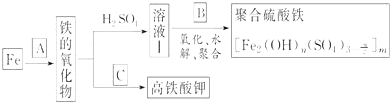
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用下列仪器组装一套装置来测定黄铁矿(主要成分FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)。实验的正确操作步骤如下:
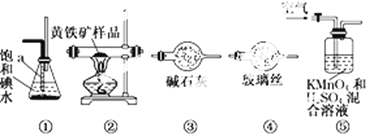
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0 g样品小心地放入硬质玻璃管中
D.以1 L/min的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800℃~850℃
F.用300 mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O = 2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mLG中所得溶液,用0.2000mol·L-1的NaOH标准溶液滴定。试回答:
(1)步骤G中所用主要仪器是______,应取_______ (填“上”或“下”)层溶液进行后续实验。
(2)装置正确的连接顺序是 ![]()
![]()
![]() ④
④ ![]() (填编号)。______
(填编号)。______
(3)装置⑤中高锰酸钾的作用是__________。持续鼓入空气的作用__________。
(4)步骤H中滴定时应选用_____作指示剂,可以根据________现象来判断滴定已经达到终点。
(5)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
滴定次数 | 待测液的体积/mL | NaOH标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
第一次 | 20.00 | 0.00 | 20.48 |
第二次 | 20.00 | 0.22 | 20.20 |
第三次 | 20.00 | 0.36 | 20.38 |
则黄铁矿样品中硫元素的质量分数为___________。
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂__________ 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
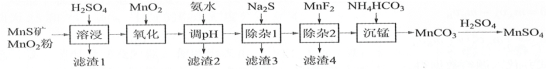
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 电解精炼Cu时,导线中通过2NAe-时,阳极质量一定减少64 g
B. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C. 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA
D. 12.0 g熔融的NaHSO4中含有离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含微粒的个数比是1∶1的是( )
A. CH3COONa溶液中CH3COO-和Na+
B. NH4+中的质子和电子
C. Na2O2固体中阴、阳离子
D. ![]() 原子中的质子和中子
原子中的质子和中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com