
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
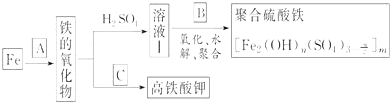
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
【答案】![]()
![]()
![]()
![]()
![]() 、3、2
、3、2 ![]()
![]()
![]() 偏高
偏高
【解析】
(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平;
(3)若C为KNO3和KOH的混合物,与Fe2O3加热共融制得高铁酸钾,则缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平;
(4)反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;根据反应2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-找出关系式Fe3+~S2O32-,然后根据关系式计算出铁离子的物质的量,再根据c=![]() 计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差。
计算出铁元素含量;根据双氧水对消耗S2O32-的物质的量的影响判断误差。
![]() 与水蒸气在高温下反应的化学方程式为:
与水蒸气在高温下反应的化学方程式为:![]()
![]()
![]() ;
;
![]() 根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,
根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,![]() 氧化
氧化![]() 为
为![]() ,本身被还原为
,本身被还原为![]() 。根据化合价升降相等配平,配平后的离子方程式为:
。根据化合价升降相等配平,配平后的离子方程式为:![]() ;
;
![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得
加热共融制得 ,则缺项中有一种为
,则缺项中有一种为![]() ,
,![]() 中铁元素化合价为
中铁元素化合价为![]() ,则亚铁离子从
,则亚铁离子从![]() 价变为
价变为![]() 价,化合价升高3价,化合价至少升高
价,化合价升高3价,化合价至少升高![]() 价;
价;![]() 中N元素从
中N元素从![]() 降为
降为![]() 中的
中的![]() 价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,
价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,![]() 的系数为3,然后根据质量守恒定律配平,配平后的方程式为:
的系数为3,然后根据质量守恒定律配平,配平后的方程式为:![]() ;
;
![]() 氧化
氧化![]() 生成
生成![]() ,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,,蓝色消失,且半分钟不变色说明是终点;
,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,,蓝色消失,且半分钟不变色说明是终点;
![]() 由
由![]() 、
、![]() 可得:
可得:![]() ,则
,则![]() ,铁元素总含量为:
,铁元素总含量为:![]() ;
;
![]() 也能氧化
也能氧化![]() 生成
生成![]() ,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。
,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)3-甲基-2-戊烯的结构简式为______________;
(2)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双键的结构不稳定)______________;
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为______________形。
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________;
(4)写出由甲苯制TNT的方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如下的烃,下列说法正确的是 ( )
① ![]() 和
和![]() 是同分异构体 ②
是同分异构体 ② ![]() 和
和![]() 是同系物
是同系物
③ ![]() 和
和![]() 都能发生加成反应 ④
都能发生加成反应 ④![]() 、
、![]() 、
、![]() 、
、![]() 都能发生取代反应
都能发生取代反应
A. ①④B. ①②C. ①②③D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌![]() 含FeO、CuO等
含FeO、CuO等![]() 制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:
制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:

![]() 该流程中物质X可以是下列中的 ________________
该流程中物质X可以是下列中的 ________________
A.ZnO B.NaOH C.Zn(OH)2 D.Na2CO3
![]() 已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐
已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐![]() ,写出反应的离子方程式_________________________;
,写出反应的离子方程式_________________________;
![]() 写出加入
写出加入![]() 时发生反应的离子方程式 _________________________________;
时发生反应的离子方程式 _________________________________;
![]() 加锌粉过滤得到的滤渣主要成分是_________
加锌粉过滤得到的滤渣主要成分是_________
![]() 上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器:_________;
上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器:_________;
![]() 检验滤液A中溶质的阴离子的方法是________________________________。
检验滤液A中溶质的阴离子的方法是________________________________。
![]() 取碱式碳酸锌水合物
取碱式碳酸锌水合物![]() ,溶于盐酸中生成二氧化碳
,溶于盐酸中生成二氧化碳![]() 标况下
标况下![]() ,溶解过程消耗氯化氢
,溶解过程消耗氯化氢![]() ,若该碱式盐中氢元素的质量分数为
,若该碱式盐中氢元素的质量分数为![]() ,试推测该碱是碳酸锌水合物的化学式是__________________。
,试推测该碱是碳酸锌水合物的化学式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()
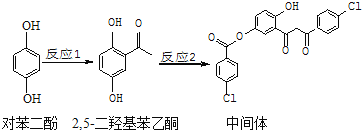
A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。

已知:i.PbCl2微溶于水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应补充完整并配平:_____
______+___Cl-+___PbS+___MnO2=___PbCl2+__SO42-+_____ +_____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__________。
(3)调pH的目的是____________。
(4)沉降池中获得PbCl2采取的措施有_________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:
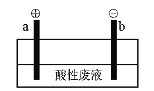
①在_____极(填“a”或“b”)获得MnO2,电极反应为_______________。
②电解过程中发现有Cl2产生,原因可能是_____________(用化学用语表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关叙述中不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH<7
B. 沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
C. 在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,则NH3H2O电离被抑制,溶液pH减少
D. 0.1mol L-1的HA溶液pH=1,该溶液中由水电离的c(OH-)=l×10-13mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列体系中,离子可能大量共存的是( )
A.滴加KSCN显红色的溶液:NH、K+、Cl-、HCO
B.常温,水电离出的c(H+)=1×10-12 mol/L的溶液:Fe2+、Mg2+、SO![]() 、NO
、NO
C.使酚酞试剂显红色的溶液:Na+、Ba2+、NO、[Al(OH)4]-
D.加入Al能产生H2的溶液:K+、NH、CH3COO-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO2气体,另一个盛有O2和N2的混和气体,则两容器内的气体一定具有相同的( )
A.密度B.原子数C.质量D.分子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com