
【题目】下列体系中,离子可能大量共存的是( )
A.滴加KSCN显红色的溶液:NH、K+、Cl-、HCO
B.常温,水电离出的c(H+)=1×10-12 mol/L的溶液:Fe2+、Mg2+、SO![]() 、NO
、NO
C.使酚酞试剂显红色的溶液:Na+、Ba2+、NO、[Al(OH)4]-
D.加入Al能产生H2的溶液:K+、NH、CH3COO-、Cl-
【答案】C
【解析】
A.滴加KSCN显红色的溶液中含有铁离子,铁离子与HCO3-发生双水解反应,在溶液中不能大量共存,故A不符合题意;
B.常温下,水电离出的c(H+)=1×10-12mol/L的溶液为酸或碱溶液,Fe2+、Mg2+与氢氧根离子反应生成沉淀,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B不符合题意;
C.使酚酞试剂显红色的溶液呈碱性,Na+、Ba2+、NO3-、[Al(OH)4]-之间不反应,且都不与氢氧根离子反应,能够大量共存,故C符合题意;
D.加入Al能产生H2的溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,CH3COO-与氢离子反应,在溶液中不能大量共存,故D不符合题意;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中可逆反应H2(g)+I2(g) ![]() 2HI (g)达到平衡状态的标志是 ( )
2HI (g)达到平衡状态的标志是 ( )
A. 混合气体的压强不再变化
B. 反应速率v(H2) =![]()
C. 混合气体的颜色不再变化
D. c(H2):c (I2):c(HI)= 1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
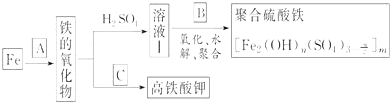
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用下列仪器组装一套装置来测定黄铁矿(主要成分FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)。实验的正确操作步骤如下:
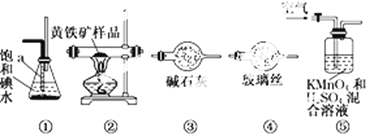
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0 g样品小心地放入硬质玻璃管中
D.以1 L/min的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800℃~850℃
F.用300 mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O = 2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mLG中所得溶液,用0.2000mol·L-1的NaOH标准溶液滴定。试回答:
(1)步骤G中所用主要仪器是______,应取_______ (填“上”或“下”)层溶液进行后续实验。
(2)装置正确的连接顺序是 ![]()
![]()
![]() ④
④ ![]() (填编号)。______
(填编号)。______
(3)装置⑤中高锰酸钾的作用是__________。持续鼓入空气的作用__________。
(4)步骤H中滴定时应选用_____作指示剂,可以根据________现象来判断滴定已经达到终点。
(5)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
滴定次数 | 待测液的体积/mL | NaOH标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
第一次 | 20.00 | 0.00 | 20.48 |
第二次 | 20.00 | 0.22 | 20.20 |
第三次 | 20.00 | 0.36 | 20.38 |
则黄铁矿样品中硫元素的质量分数为___________。
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂__________ 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
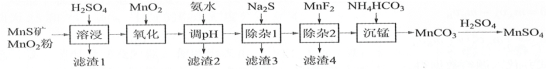
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(III)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+=4Cr3++7O2+6H2O)。下列有关说法正确的是( )
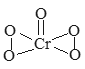
A. CrO5中Cr元素的化合价为+10
B. 过氧化铬中含有极性共价键、非极性共价键和离子键
C. 过氧化铬具有较强的氧化性
D. 上述反应每转移0.2mol电子就能生成2.24LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 电解精炼Cu时,导线中通过2NAe-时,阳极质量一定减少64 g
B. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C. 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA
D. 12.0 g熔融的NaHSO4中含有离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2O5是钒的重要化合物,工业上多由各种类型的钒矿石提取。根据描述写方程式。
(1)用氯化焙烧法处理钒铅矿。具体为将食盐和钒铅矿(主要含V2O5)在空气中焙烧,产生黄绿色气体,并生成NaVO3。写出化学方程式___________;
(2)V2O5具有微弱的碱性,溶于强酸,当pH=1时生成淡黄色的VO2+___________;酸性介质中VO2+是一种较强的氧化剂,可以被草酸(H2C2O4)还原为VO2+_____________,I-能将VO2+还原为V3+____________(写出对应离子方程式);
(3)V2O5也是一种强氧化剂,溶于盐酸被还原为VOCl2,并放出氯气。写出对应化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com