
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
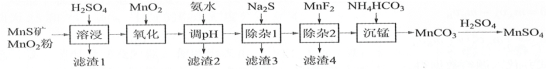
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
【答案】SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 NiS和ZnS F与H+结合形成弱电解质HF,MgF2(s)Mg2++2F平衡向右移动 Mn2++2![]() =MnCO3↓+CO2↑+H2O
=MnCO3↓+CO2↑+H2O
【解析】
硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素),MnS矿和MnO2粉加入稀硫酸,MnO2具有氧化性,二者发生氧化还原反应生成MnSO4、S,同时溶液中还有难溶性的SiO2及难溶性的硅酸盐,所以得到的滤渣1为SiO2和S和难溶性的硅酸盐;然后向滤液中加入MnO2,将还原性离子Fe2+氧化生成Fe3+,再向溶液中加入氨水调节溶液的pH除铁和铝,所以滤渣2为Fe(OH)3、Al(OH)3;根据流程图,结合表格数据,加入的Na2S和Zn2+、Ni2+反应生成硫化物沉淀,“除杂1”的目的是除去Zn2+和Ni2+,所以滤渣3为NiS和ZnS;“除杂2”的目的是生成MgF2沉淀除去Mg2+,所以滤渣4为MgF2,最后向滤液中加入碳酸氢铵得到MnCO3沉淀,用稀硫酸溶解沉淀MnCO3得到硫酸锰,据此分析解答。
(1)根据上述分析,“滤渣1”含有S和难溶性的二氧化硅或硅酸盐;“溶浸”中二氧化锰与硫化锰发生氧化还原反应生成锰离子、S和水,离子方程式为MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,故答案为:SiO2(不溶性硅酸盐);MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(2)MnO2具有氧化性,能氧化还原性离子Fe2+生成Fe3+,从而在调节pH时除去这两种离子,故答案为:将Fe2+氧化为Fe3+;
(3)“调pH”除铁和铝,溶液的pH应该大于这两种离子完全沉淀所需pH且小于其它离子生成沉淀的pH值,在pH=4.7时Fe3+和Al3+沉淀完全,在pH=6.2时Zn2+开始产生沉淀,为了只得到氢氧化铝和氢氧化铁沉淀,需要溶液的pH范围为4.7~6之间,故答案为:4.7;
(4)“除杂1”的目的是除去Zn2+和Ni2+,这两种离子和硫离子生成硫化物沉淀,所以滤渣3为NiS和ZnS,故答案为:NiS和ZnS;
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+,溶液中存在MgF2的溶解平衡,如果溶液酸性较强,生成弱电解质HF而促进氟化镁溶解,即F-与H+结合形成弱电解质HF,MgF2(s)Mg2++2F-平衡向右移动,所以镁离子沉淀不完全,故答案为:F-与H+结合形成弱电解质HF,MgF2(s)Mg2++2F-平衡向右移动;
(6)“沉锰”时锰离子和碳酸氢根离子反应生成碳酸锰沉淀,同时还生成水、二氧化碳,离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是
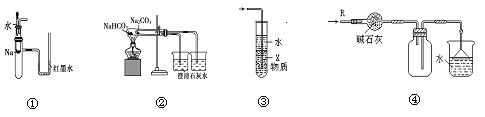
A.装置①可用于验证Na与H2O反应是否放热
B.装置②可用于比较Na2CO3与NaHCO3的稳定性
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()
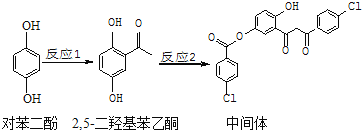
A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关叙述中不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH<7
B. 沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
C. 在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,则NH3H2O电离被抑制,溶液pH减少
D. 0.1mol L-1的HA溶液pH=1,该溶液中由水电离的c(OH-)=l×10-13mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列体系中,离子可能大量共存的是( )
A.滴加KSCN显红色的溶液:NH、K+、Cl-、HCO
B.常温,水电离出的c(H+)=1×10-12 mol/L的溶液:Fe2+、Mg2+、SO![]() 、NO
、NO
C.使酚酞试剂显红色的溶液:Na+、Ba2+、NO、[Al(OH)4]-
D.加入Al能产生H2的溶液:K+、NH、CH3COO-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型纳米材料的主要成分为MFe2Ox(3<x<4),其中M表示+2价的金属元素,下列说法正确的是( )
A.MFe2Ox中铁元素的化合价一定为+2B.320g MFe2Ox的物质的量大于2mol
C.1mol MFe2Ox中Fe的质量为112 gD.1mol MFe2Ox的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法可用于治理亚硝酸盐对水体的污染,模拟工艺如图所示,下列说法不正确的是
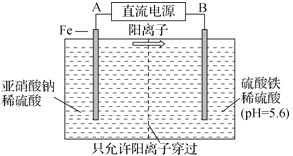
A. A、B分别为直流电源的正极和负极
B. 当电解过程转移0.6mol电子时,左侧区域质量减少1.4g
C. 电解过程中,左侧区域将依次发生反应为:Fe-2e-=Fe2+ 、2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O
D. 研究表明,当右侧区域pH较小时,会有气体逸出,该现象说明H+的氧化性强弱与其c(H+)有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 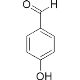 的熔沸点明显高于
的熔沸点明显高于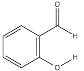 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com