
【题目】某新型纳米材料的主要成分为MFe2Ox(3<x<4),其中M表示+2价的金属元素,下列说法正确的是( )
A.MFe2Ox中铁元素的化合价一定为+2B.320g MFe2Ox的物质的量大于2mol
C.1mol MFe2Ox中Fe的质量为112 gD.1mol MFe2Ox的体积为22.4 L
【答案】C
【解析】
A.根据化合价代数和为0进行计算;
B. 设x=3,此时320g MFe2Ox的物质的量最大;
C. 1mol MFe2Ox中Fe的物质的量为2mol;
D. MFe2Ox的状态不确定,所处的条件不确定,无法计算。
A. M表示+2价的金属元素,如果铁的化合价为+2价,那么2+2×2=2x,解得x=3,而(3<x<4),不和题意,A项错误;
B. 设x=3,此时MFe2Ox的物质的量=![]() =
=![]() <2,因此320g MFe2Ox的物质的量小于2mol,B项错误;
<2,因此320g MFe2Ox的物质的量小于2mol,B项错误;
C. 1mol MFe2Ox中Fe的物质的量为2mol,质量为56g/mol×2mol=112g,C项正确;
D. MFe2Ox的状态不确定,所处的条件不确定,无法计算,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序
及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序
①过滤②加过量的NaOH溶液③加过量的盐酸④加过量的Na2CO3溶液⑤加过量的BaCl2溶液⑥加热蒸发
A.④①⑤②①③⑥B.⑤①④②③⑥C.②⑤④①③⑥D.①②⑤④①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
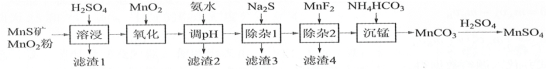
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
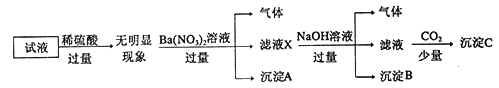
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 电解精炼Cu时,导线中通过2NAe-时,阳极质量一定减少64 g
B. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C. 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA
D. 12.0 g熔融的NaHSO4中含有离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为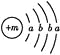 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
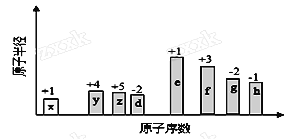
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com