
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
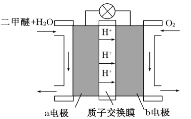
a电极是________极,其电极反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个铜锌双液原电池装置图,下列说法正确的是

A. 盐桥中的阴离子向CuSO4溶液中移动
B. 盐桥的作用之一是平衡电荷
C. 铜片作电池的负极
D. 电子从锌电极经溶液流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)很多含氯物质都能做消毒剂。液氯可以用于饮用水消毒,但是消毒后的水中可能产生危害人体健康的有机氧化物。世界各国陆续开发新型自来水消毒剂,下列物质可以用于自来水消毒的有___。
A.Na2O2 B.Cl2O2 C.O3 D.O2 E.ClO2
(2)Na2FeO4为紫色物质,也可以用于自来水消毒,高铁酸钠处理过的水中含有氢氧化铁胶体,用激光笔照射,可以从侧面看到一条光路,这个现象在化学上被成为___。
(3)漂白液是一种常用消毒剂,其中的有效成分是___(写出化学式)。
(4)漂白粉也是常见消毒剂。工业上使用漂白粉一般加入少量盐酸或醋酸,促使___(填写出物质名称)产生,以增强漂白杀菌作用。请用化学方程式表示家用漂白粉不加入酸如何产生该物质___。
(5)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。请配平完成该过程的化学方程式:__Ca(ClO)2+__HCl=__Cl2↑+__CaCl2+__。生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯=(漂白粉加酸所释放出的氯气的质量/漂白粉的质量)×100%。漂白粉的有效氯一般高于30%,某化工厂漂白粉2g进行上述一系列反应进行测定,消耗硫代硫酸钠0.02mol,则其有效氯为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
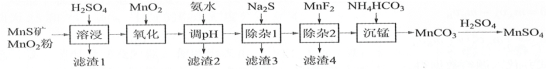
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
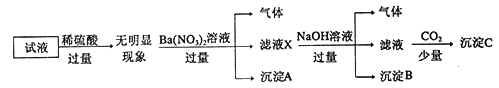
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com