
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
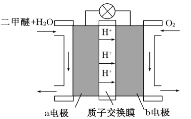
a电极是________极,其电极反应方程式为_________________。
【答案】自发 -246.1 kJ/mol ![]() > CO、H2、甲醇和水 负 CH3OCH3-12e-+3H2O=2CO2+12H+
> CO、H2、甲醇和水 负 CH3OCH3-12e-+3H2O=2CO2+12H+
【解析】
Ⅰ.(1)依据自发进行的判断依据为△H-T△S<0,是自发进行的反应;△H-T△S>0,是非自发进行的反应;
(2)依据热化学方程式和盖斯定律计算得到热化学方程式;根据化学平衡常数的含义可得其表达式;催化反应室内的反应条件是压力2.0~10.0Mpa,温度230~280℃;结合影响化学平衡的因素分析判断;
(3)依据反应过程中的中间产物是可以循环利用的物质;
Ⅱ.反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,O2在正极发生还原反应,氧气在正极放电,由图中H+的移动方向知,a极为负极,二甲醚放电生成二氧化碳与氢离子。
I.(1)甲烷氧化可制合成气:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g),△S>0,△H<0,△H-T△S<0,因此反应能自发进行;
CO(g)+2H2(g),△S>0,△H<0,△H-T△S<0,因此反应能自发进行;
(2)催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
依据盖斯定律①×2+②+③得到:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)ΔH=-246.1kJ/mol;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的化学平衡常数表达式为K=
CH3OCH3(g)+CO2(g)ΔH=-246.1kJ/mol;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的化学平衡常数表达式为K=![]() ;
;
在830℃时反应的K=1.0,在催化反应室中,压力2.0~10.0Mpa,温度230~280℃,温度降低,平衡向正反应方向移动,因此反应的K增大;
(3)依据催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应,
①CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
甲醇和水是中间产物,结合生产流程,CO、H2也可以部分循环,故可以循环利用的物质CO、H2、甲醇和水。
II.在该燃烧电池中,根据H+的移动方向可知,通入二甲醚的a电极为负极,二甲醚在负极失去电子,发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
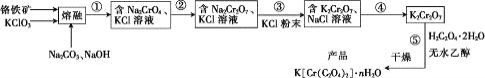
回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
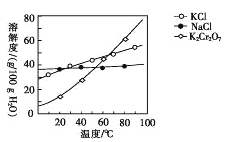
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将苯的蒸汽通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯化物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是(提示:在一定条件下,醛基也可以与H2发生加成反应)( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. 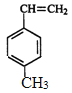
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
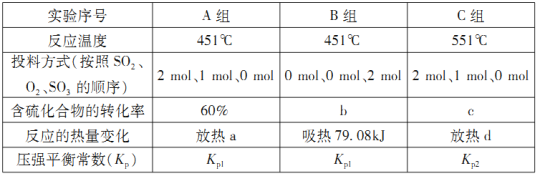
①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1___________Kp2(填“>”、“<”或“=”)。
③451℃,若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是
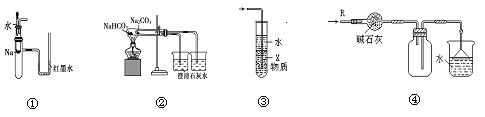
A.装置①可用于验证Na与H2O反应是否放热
B.装置②可用于比较Na2CO3与NaHCO3的稳定性
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
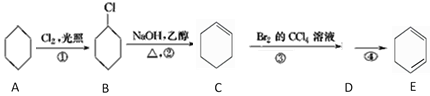
(1)A的名称是________________ ;B的分子式为______________。
(2)反应①的方程式为:________________;反应②为_______________反应;反应④的化学方程式是__________________。
(3)写出B在NaOH水溶液中加热的反应方程式:_____________,生成物官能团的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com