
【题目】按要求回答下列问题:
(1)3-甲基-2-戊烯的结构简式为______________;
(2)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双键的结构不稳定)______________;
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为______________形。
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________;
(4)写出由甲苯制TNT的方程式_________________________________________。
【答案】![]() CH2=CH-C≡CH 正四面体 C2H6O
CH2=CH-C≡CH 正四面体 C2H6O 
【解析】
(1)由3-甲基-2-戊烯的名称可知主链有5个碳原子,在3号碳原子上有甲基,2、3号碳有双键,所以结构简式为![]() ,答案:
,答案:![]() 。
。
(2)①由分子式为C4H4知不饱和度为3,所以链式结构含双键和三键,结构简式为CH2=CH-C≡CH ,答案是: CH2=CH-C≡CH。
②它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C原子形成类似白磷(P4)的正四面体结构,因此,本题正确答案是:正四面体.
(3)根据质量守恒定律可以知道,化合物中所含C元素质量为:![]() =2.4g,所含H元素质量为:
=2.4g,所含H元素质量为:![]() 0.6g,二氧化碳和水中的氧元素质量之和为(8.8-2.4)+(5.4-0.6)=11.2g,而氧气的质量为: 6.72L÷22.4L
0.6g,二氧化碳和水中的氧元素质量之和为(8.8-2.4)+(5.4-0.6)=11.2g,而氧气的质量为: 6.72L÷22.4L![]() mol-1
mol-1![]() 32g/mol=9.6g,所以有机物中氧元素质量为11.2g-9.6g =1.6g,三种元素原子的个数比为:n(C):n(H):n(O)=2:6:1,所以化合物的最简式是C2H6O,答案:C2H6O。
32g/mol=9.6g,所以有机物中氧元素质量为11.2g-9.6g =1.6g,三种元素原子的个数比为:n(C):n(H):n(O)=2:6:1,所以化合物的最简式是C2H6O,答案:C2H6O。
(4)由甲苯和浓硝酸、浓硫酸在加热的条件下反应生成2,4,6-三硝基甲苯即TNT和水,反应的方程式为: ;答案:
;答案: 。
。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为____________mol/L
(2)应量取63%的浓硝酸_____________mL,应选用___________。(填仪器的字母编号)
(3)实验时还需选用的仪器有______________(填仪器的字母编号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是______(填序号)。 |
A.可以按此建议改进,便于使用容量瓶 |
B.不能按此建议改进,因为会降低容量瓶的精确度 |
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2+2H2O,
(1)双线桥表示氧化还原,线桥上标明得失电子、发生的反应。_______
(2)若1mo KClO3参加反应时有_______mol电子转移。
(3)若生成标准状况下的CO2的体积是44.8L,则参加反应的还原剂的物质的量是多少mol?(要求有规范的过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某K2SO4溶液的浓度,取25mL待测液。向其中加入过量BaCl2溶液,充分反应后过滤并燥,得到BaSO4沉淀4.46g,该K2SO4溶液的物质的量浓度是多少?(要求写出具体的计算过程,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。下面几种有机化合物的转化关系:
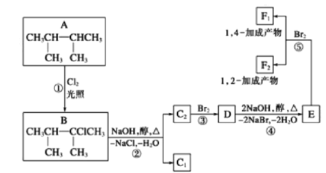
(1)根据系统命名法,化合物A的名称是_________
(2)写出物质D中所含官能团的名称_____________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式___________
(4)C2的结构简式是____________,F1的结构简式是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制480mL0.2mol·L-1的NaOH溶液。
(1)通过计算可知,应用托盘天平称量_____克NaOH固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____。
(3)从下面选出所需的操作并写出正确的顺序_____(填字母)。
A.洗涤 B.冷却 C.量取 D.称量 E.定容 F.转移溶液 G.稀释 H.溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)。
①定容时加蒸馏水不慎超过了刻度_____;
②容量瓶不干燥,有一定的水分_____;
③定容时仰视观察到液面刚好到达刻度线_____。
(5)该NaOH溶液与2.24L氯气(STP)下恰好完全反应,需氢氧化钠溶液_____mL。
(6)用18mol·L-1的硫酸配制100mL1.0 mol·L-1硫酸,实验时应选用的仪器是_____(填编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
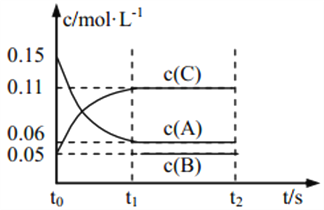
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中可逆反应H2(g)+I2(g) ![]() 2HI (g)达到平衡状态的标志是 ( )
2HI (g)达到平衡状态的标志是 ( )
A. 混合气体的压强不再变化
B. 反应速率v(H2) =![]()
C. 混合气体的颜色不再变化
D. c(H2):c (I2):c(HI)= 1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
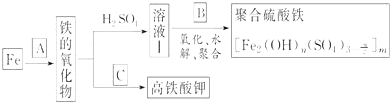
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com