
| 2×11+2-14 |
| 2 |
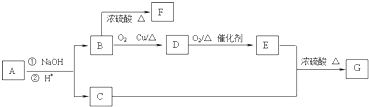
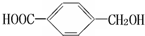 ,则B为CH3CH2CH2OH,A为
,则B为CH3CH2CH2OH,A为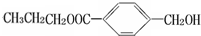 ,B发生消去反应生成F为CH3CH=CH2,B发生氧化反应生成D为CH3CH2CHO,丙醛进一步发生氧化反应生成E为CH3CH2COOH,E与C发生酯化反应生成G为
,B发生消去反应生成F为CH3CH=CH2,B发生氧化反应生成D为CH3CH2CHO,丙醛进一步发生氧化反应生成E为CH3CH2COOH,E与C发生酯化反应生成G为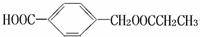 ,据此解答.
,据此解答.| 2×11+2-14 |
| 2 |
 ,则B为CH3CH2CH2OH,A为
,则B为CH3CH2CH2OH,A为 ,B发生消去反应生成F为CH3CH=CH2,B发生氧化反应生成D为CH3CH2CHO,丙醛进一步发生氧化反应生成E为CH3CH2COOH,E与C发生酯化反应生成G为
,B发生消去反应生成F为CH3CH=CH2,B发生氧化反应生成D为CH3CH2CHO,丙醛进一步发生氧化反应生成E为CH3CH2COOH,E与C发生酯化反应生成G为 ,
,| 催化剂 |
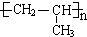 ,
,| 催化剂 |
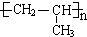 ;
;| △ |
| △ |
 ,以C为单体可以得到合成树脂,C生成合成树脂的化学方程式:
,以C为单体可以得到合成树脂,C生成合成树脂的化学方程式: ,
, ;
; ;9;
;9;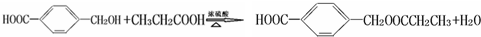 ,
,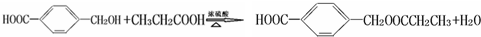 .
.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钾 | 碳酸 | 苏打 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
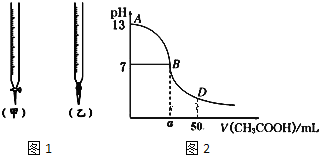
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
滴定次数 | 待测氢氧化钠溶液 的体积(ml) | 0.100mol/L醋酸的体积 | |
| 滴定前的刻度(ml) | 滴定后的刻度(ml) | ||
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
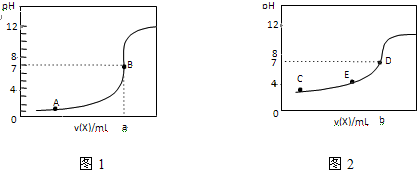
| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com