
【题目】2019年诺贝尔化学奖已授予约翰·班宁斯特·古迪纳夫、斯坦利·惠廷汉姆和吉野彰,三位科学家的获奖理由是为锂电池的发展做出了卓越贡献。下图是我国一项电解制备金属锂的新方法发明专利装置图。下列说法不正确的是
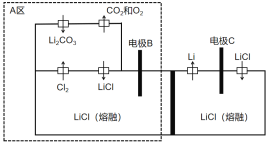
A.电极B的电势比电极C高
B.理论上该装置不需要补充电解质LiCl
C.电极B中氯离子和碳酸根离子放电
D.A区避免熔融碳酸锂对设备的腐蚀且减少了环境污染
【答案】C
【解析】
由题意可知,该图是我国一项电解制备金属锂的新方法发明专利装置图。电极C由Li+生成Li,故电极C为阴极,电极B为阳极,阴极发生还原反应、阳极发生氧化反应。
A.电极C为阴极,电极B为阳极,阳极的电势比阴极的电势高,A正确;
B.阳极的电极反应式为2Cl--2e-=2Cl-,阴极的电极反应式为2Li++2e-=2Li,阳极产生的氯气与碳酸锂反应生成氯化锂,故理论上该装置不需要补充电解质LiCl,B正确;
C.电极B中氯离子放电,碳酸根离子不放电,C错误;
D.阳极产生的氯气与碳酸锂反应生成氯化锂、氧气、二氧化碳,故避免熔融碳酸锂对设备的腐蚀且减少了环境污染,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
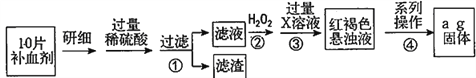
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面物质间转换的框图,回答有关问题:
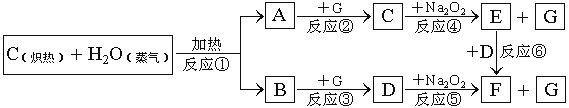
(1)写出框图中物质A、B、E、F分别指代物质的化学式:A._____________ B._____________ E._____________ F.______________
(2)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积_________L;同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(3)如果A、B混合气体3.0g(平均摩尔质量15g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重__________g,并得到O2_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两种常见金属A(地壳中含量第二的金属)、B(红色金属)分别与两种酸X、Y发生反应,其转化关系如图所示,其中D为红棕色气体。
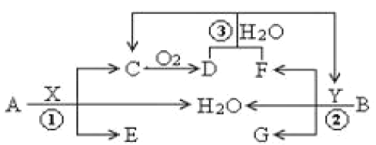
回答以下问题:
(1)反应③的离子反应方程式为___;
(2)6.4gB与过量X溶液(8mol /L、60mL)充分反应后,生成的还原产物有C、D,反应后溶液中所含X为n mol ,此时溶液中所含X的阴离子的物质的量为___mol。
(3)常温下A与Y的稀溶液能发生反应生成盐W,关于固体W的转化关系如图所示(无关物质已略去)。其中N是红棕色的化合物。
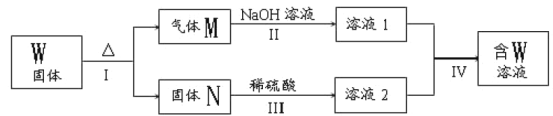
①M由两种化合物组成,其中含有F;将M通入BaCl2溶液,实验现象是___。
②若经反应I得到16 g固体N,产生的气体M恰好被0.3L1mol·L-1 NaOH溶液完全吸收得溶液1,则反应Ⅳ中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基二茂铁常用作火箭燃料添加剂、汽油抗爆剂等。某兴趣小组制备乙酰基二茂铁,流程如下:

已知:
a.反应原理:![]() +(CH3CO)2O
+(CH3CO)2O![]() CH3COOH+
CH3COOH+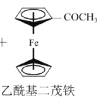
b.二茂铁熔点173℃,沸点249℃,100℃易升华。
c.乙酰基二茂铁熔点81℃,沸点163℃。不溶于水,易溶于有机溶剂。
请回答:
(1)步骤I,在50 mL圆底烧瓶中,加入新制的、经提纯后0.5 g二茂铁,5 mL乙酸酐,在振摇下滴入1 mL 85%磷酸,提纯二茂铁的方法为_______________。
(2)步骤II,加料毕,用装填有CaCl2的干燥管塞住圆底烧瓶瓶口。如图所示,其目的是__________。

(3)步骤IV,反应完毕后,将紫色混合物倾入含40 g碎冰烧杯中,并用10 mL冷水洗涤烧瓶,将洗涤液并入烧杯,在搅拌下加入NaHCO3(s),判断溶液呈中性的实验方法为__________。
(4)步骤V,包括结晶、吸滤、洗涤、干燥等多步操作。下列说法正确的是__________。
A.为较快地析出晶体,可以用玻璃棒摩擦烧杯内壁
B.吸滤装置由吸滤瓶、布氏漏斗、抽气泵组成
C.宜用乙醇洗涤,洗涤后乙醇易挥发
D.可在100℃红外灯下干燥
(5)①粗产品中含有杂质为___________,可以用来鉴别的仪器是___________。
②分离提纯粗产品后,用薄层层析来测定Rf值。选出其正确操作并按序列出字母:a→c→_______→_______→________→_________→g。
a.制备薄层色谱板
b.用少量纯二茂铁和提纯后的产品分别溶于2 mL甲苯中,配成浓溶液
c.用细玻璃管拉制两根微量滴管(尖端处约0.7mm)
d.将色谱板插入盛有乙醚的槽内,盖上盖子
e.待溶剂上升到色谱板3/4高度时,取出色谱板,并标记溶剂所到高度
f.分别用微量滴管浸入两浓溶液,在色谱板两原点处点样,待干燥后,再重复点样
g.计算Rf值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃 (THF)常用于药物合成,结构如下图,下列关于该化合物的说法错误的是
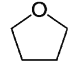
A.二氯代物有五种
B.与丁醛互为同分异构体
C.所有碳原子不能处于同一平面
D.1mol呋喃(![]() )生成1 mol 四氢呋喃需要2 mol H2
)生成1 mol 四氢呋喃需要2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
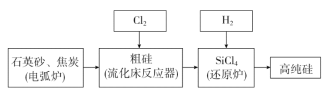
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )

A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、N是中学化学常见的三种元素,请依据这些元素组成的物质回答下列问题:
(1)钠可以和TiCl4反应制取金属Ti,体现钠的__性。
(2)氯碱工业是利用电解氯化钠溶液制取烧碱和氯气,其反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
(3)写出Fe2O3的一种用途__,请设计实验证明赤铁矿中含有铁元素___。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),离子方程式为__。
(5)将一小块Cu片放入盛有稀硝酸的试管中,可观察到试管口气体颜色为__;其铜和稀硝酸反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com