
【题目】Na、Fe、N是中学化学常见的三种元素,请依据这些元素组成的物质回答下列问题:
(1)钠可以和TiCl4反应制取金属Ti,体现钠的__性。
(2)氯碱工业是利用电解氯化钠溶液制取烧碱和氯气,其反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
(3)写出Fe2O3的一种用途__,请设计实验证明赤铁矿中含有铁元素___。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),离子方程式为__。
(5)将一小块Cu片放入盛有稀硝酸的试管中,可观察到试管口气体颜色为__;其铜和稀硝酸反应的离子方程式为___。
【答案】还原 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 氢氧化钠溶液 作颜料或冶炼铁 取少量赤铁矿溶于酸(盐酸等),滴加KSCN溶液变红,说明含铁元素 2Fe3++Cu=2Fe2++Cu2+ 红棕色 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
2OH-+H2↑+Cl2↑ 氢氧化钠溶液 作颜料或冶炼铁 取少量赤铁矿溶于酸(盐酸等),滴加KSCN溶液变红,说明含铁元素 2Fe3++Cu=2Fe2++Cu2+ 红棕色 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
(1)钠和TiCl4反应制取金属Ti,Na的化合价升高;
(2)反应中气体、弱电解质写化学式;氯气可与NaOH反应;
(3)氧化铁是红棕色固体难溶于水,可以作颜料或冶炼铁;证明赤铁矿中含有铁元素,可以取少量赤铁矿溶于盐酸后滴加KSCN溶液检验是否含铁离子;
(4)工业常用FeCl3溶液刻蚀印刷电路板是氯化铁和铜反应生成氯化亚铁和氯化铜;
(5)Cu与稀硝酸反应生成硝酸铜、NO和水;NO遇到空气中的氧气反应生成红棕色的NO2。
(1)钠和TiCl4反应制取金属Ti,Na的化合价升高,表现还原性;
(2)反应中气体、弱电解质写化学式,则离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;氯气可与NaOH反应,可用NaOH溶液吸收;
2OH-+H2↑+Cl2↑;氯气可与NaOH反应,可用NaOH溶液吸收;
(3)氧化铁是红棕色固体难溶于水,可以作颜料或冶炼铁;证明赤铁矿中含有铁元素,可以取少量赤铁矿溶于盐酸后滴加KSCN溶液检验是否含铁离子;
(4)工业常用FeCl3溶液刻蚀印刷电路板是氯化铁和铜反应生成氯化亚铁和氯化铜,离子反应的方程式为:2Fe3++Cu=2Fe2++Cu2+;
(5)Cu与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;NO遇到空气中的氧气反应生成红棕色的NO2。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖已授予约翰·班宁斯特·古迪纳夫、斯坦利·惠廷汉姆和吉野彰,三位科学家的获奖理由是为锂电池的发展做出了卓越贡献。下图是我国一项电解制备金属锂的新方法发明专利装置图。下列说法不正确的是
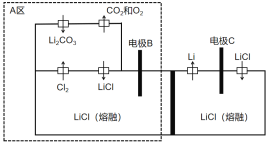
A.电极B的电势比电极C高
B.理论上该装置不需要补充电解质LiCl
C.电极B中氯离子和碳酸根离子放电
D.A区避免熔融碳酸锂对设备的腐蚀且减少了环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y 原子最外层电子数等于内层电子数的2 倍,Q 的单质与稀硫酸反应生成X的单质。向100mLX2R 的水溶液中缓缓通入RZ2气体,溶液 pH 与 RZ2体积关系如下图。下列说法不正确的是
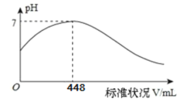
A.X2R溶液的浓度为0.4mol/L
B.X简单阴离子半径大于锂离子半径
C.工业上采用电解熔融Q的氧化物的方法冶炼Q 的单质
D.RZ3 通入BaCl2、Ba(NO3)2溶液中,均产生相同的白色沉淀物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素。
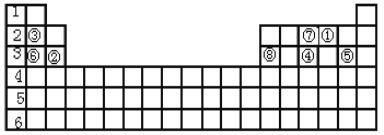
根据上表回答下列问题。
(1)元素①的原子序数是____,由元素①构成三原子单质的分子名称是____。
(2)元素④与⑦相比,____元素的原子半径较大,____元素的氢化物更稳定(用元素符号填写)。
(3)元素③与⑥相比,最高价氧化物对应水化物碱性较大的是________(填碱的化学式)。
(4)元素②和⑧的氧化物常用做耐火材料。元素②的氧化物的化学式是______,元素⑧的氢氧化物与烧碱溶液反应的化学方程式是____________。
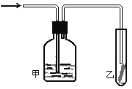
(5)如图,将潮湿的由元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是______。
a.稀硫酸 b.浓硫酸 c.水 d.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:已知(a、b、c均大于零):H2(g)+I2(g) ![]() 2HI(g) ΔH=-a kJ·mol-1。
2HI(g) ΔH=-a kJ·mol-1。
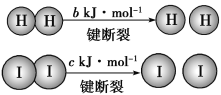
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化为Fe2+。人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
(2)请按要求正确书写:
①“铁与硫酸铜溶液反应”(离子方程式):__;
②用CO还原Fe2O3(化学方程式):__。
(3)某一反应中有反应物和生成物的粒子共6种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是__(填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子数为__。
③写出该反应的离子方程式(用单线桥法表示出电子的转移方向及数目)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
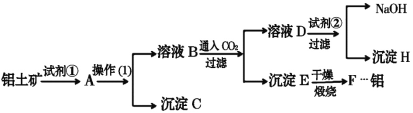
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
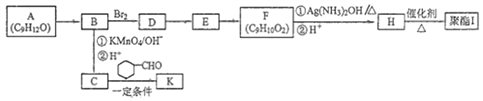
已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②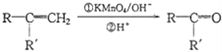 +CO2
+CO2
③RCOCH3+R'CHO![]() RCOCH=CHR'+H2O
RCOCH=CHR'+H2O
回答下列问题:
(1)A生成B的反应类型为__________,由D生成E的反应条件为_______________。
(2)H中含有的官能团名称为______________。
(3)I的结构简式为__________________________。
(4)由E生成F的化学方程式为____________________________________________。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:___________________。
①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
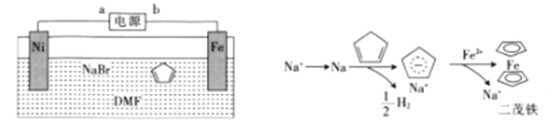
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.二茂铁制备过程中阴极的电极反应为2H++2e-=H2↑
D.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com