
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
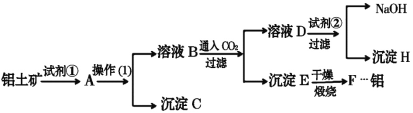
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
【答案】过滤 Ca(OH)2 或Ba(OH)2 NaAlO2 Na2CO3 CaCO3或BaCO3 Al2O3+2NaOH=2NaAlO2+H2O 2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
根据题干,我们要除去铝土矿中的![]() 来得到纯的氧化铝,根据题干提示的方程式,溶液B是
来得到纯的氧化铝,根据题干提示的方程式,溶液B是![]() ,因此试剂①应该是
,因此试剂①应该是![]() ,操作(1)是过滤除去不溶于
,操作(1)是过滤除去不溶于![]() 的
的![]() ,沉淀C为
,沉淀C为![]() ,溶液B中通入
,溶液B中通入![]() 得到
得到![]() 溶液D和
溶液D和![]() 沉淀E,
沉淀E,![]() 经煅烧分解得到
经煅烧分解得到![]() ,经电解即可得到金属铝。而
,经电解即可得到金属铝。而![]() 与试剂②反应得到了一个沉淀H和
与试剂②反应得到了一个沉淀H和![]() ,因此试剂②可以是
,因此试剂②可以是![]() 或
或![]() ,本题得解。
,本题得解。
(1)根据分析,操作(1)将溶液和沉淀分离,因此是过滤;试剂②是![]() 或
或![]() ;
;
(2)根据分析,B是![]() ;D是
;D是![]() ;H是
;H是![]() 或
或![]() ,取决于试剂②是
,取决于试剂②是![]() 还是
还是![]() ;
;
(3)①铝土矿的主要成分![]() ,因此写出
,因此写出![]() 和
和![]() 溶液反应的化学方程式即可:
溶液反应的化学方程式即可:![]() ;
;
②E→F即煅烧使![]() 分解的过程:
分解的过程:![]() 。
。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】![]() 是大气污染物之一,实验室拟将
是大气污染物之一,实验室拟将![]() 与
与![]() 混合用
混合用![]() 溶液吸收的方法消除其污染。回答下列问题:
溶液吸收的方法消除其污染。回答下列问题:
(1)氯气的制备
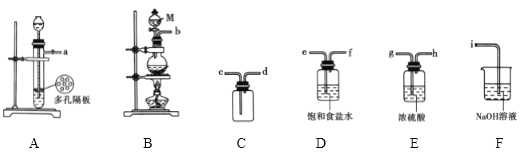
①仪器M的名称是_______________
②欲用![]() 和浓盐酸制备并收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为____________(按气流方向,用小写字母表示)。
和浓盐酸制备并收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为____________(按气流方向,用小写字母表示)。
③D在制备装置中的作用是______________;装置F的作用是__________________。
(2)用如下图所示装置,探究![]() 和
和![]() 在
在![]() 溶液中的反应。查阅有关资料可知:
溶液中的反应。查阅有关资料可知:![]() 是一种弱酸,且不稳定,易分解生成
是一种弱酸,且不稳定,易分解生成![]() 和
和![]() 。
。
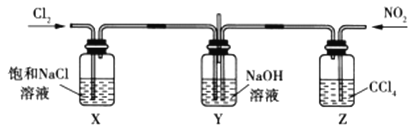
①装置中X和Z的作用是_______________
②实验时观察到X试剂瓶中有黄绿色气体,Z试剂瓶中有红棕色气体,若通入适当比例的![]() 和
和![]() ,Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是___________。
,Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是___________。
③反应结束后,取Y中溶液适量置于试管中,加入稀硫酸,若有红棕色气体产生,解释产生该现象的原因_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,E的元素符号为___________
(2)A、B两种元素可形成化学式为B2A、B2A2等化合物,则B2A2的电子式为_____。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________
(4)DA2与E元素的单质在水中反应的离子方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
A.混合气体中H2O的体积分数保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 molH2,同时生成1 mol CH3OH
D.反应中CO2与CH3OH的物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以甲烷、氧气为原料,KOH溶液作为电解质构成燃料电池,总反应式为____,如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:____;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH﹣物质的量浓度为0.01molL﹣1(25℃下测定),则理论上消耗氧气的体积为____mL(标况下)。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__ (填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D.H2O
电解后电解质溶液的pH值__(填“增大”“减小”或“不变”);写出电解总离子方程式____。
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Pt电极名称是__;发生的电极反应式为__。
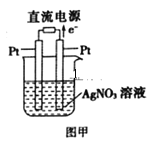
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中一定能大量共存的是
A. ![]() =1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
=1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
B. 遇苯酚显紫色的溶液中:NH4+、K+、Cl-、SO42-
C. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、SO42-、C6H5OH、Cl-
D. 饱和氨水中:Ag+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种新粒子是由3个氢原子核(只含质子)和2个电子构成的。对于这种粒子,下列说法中正确的是
A.是氢的一种新的同素异形体B.它比一个普通H2分子多一个氢原子核
C.是氢的一种新的同位素D.它的组成可用H3表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
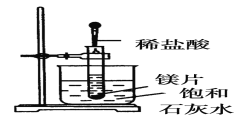
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________。
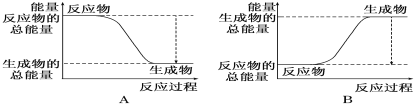
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com