
【题目】(1)以甲烷、氧气为原料,KOH溶液作为电解质构成燃料电池,总反应式为____,如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:____;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH﹣物质的量浓度为0.01molL﹣1(25℃下测定),则理论上消耗氧气的体积为____mL(标况下)。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__ (填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D.H2O
电解后电解质溶液的pH值__(填“增大”“减小”或“不变”);写出电解总离子方程式____。
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Pt电极名称是__;发生的电极反应式为__。
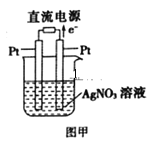
【答案】CH4+2O2+2KOH=K2CO3+3H2O 2Cl--2e-=Cl2↑ 56mL A 减小 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 阴极 Ag++e-=Ag
2Cu+O2↑+4H+ 阴极 Ag++e-=Ag
【解析】
(1)甲烷、氧气、KOH构成燃料电池,相当于燃料在氧气中燃烧,其总反应式为CH4+2O2+2KOH=K2CO3+3H2O;如果以该燃料电池为电源,石墨作两极电解饱和食盐水,根据电解原理,阳极与电池的正极相连,失电子化合价升高,阳极电极反应式为2Cl--2e-=Cl2↑;电解饱和食盐水总反应是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据转移电子数目相等,建立关系式为O2~4e-~4NaOH,消耗氧气的物质的量为1L×0.01mol·L-1/4=0.0025mol,标准状况下,V(O2)=0.0025mol×22.4L·mol-1=0.056L,合56mL;
2NaOH+H2↑+Cl2↑,根据转移电子数目相等,建立关系式为O2~4e-~4NaOH,消耗氧气的物质的量为1L×0.01mol·L-1/4=0.0025mol,标准状况下,V(O2)=0.0025mol×22.4L·mol-1=0.056L,合56mL;
(2)用惰性材料作电极,总电极反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,当c(Cu2+)降至原来的一半时停止通电,脱离体系的是Cu和O2,因此恢复到电解前的状态需要加入物质是CuO,故A正确;根据总电极反应式,产生硫酸,溶液的pH减小;总电极的离子方程式为2Cu2++2H2O
2Cu+O2↑+2H2SO4,当c(Cu2+)降至原来的一半时停止通电,脱离体系的是Cu和O2,因此恢复到电解前的状态需要加入物质是CuO,故A正确;根据总电极反应式,产生硫酸,溶液的pH减小;总电极的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
(3)根据电子转移方向,右侧Pt为阳极,左侧Pt为阴极,根据电解原理,阳离子在阴极上得电子,即电极反应式为Ag++e-=Ag。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式__________,将54.8g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=__,气体V=___。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______,若有2mol氯气参与该反应,则此时转移的电子数为___NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为______。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O

请回答:
(1)甲池是________,通入O2的电极作为________极,电极反应式为_____________。
(2)乙池是________,A电极名称为________极,电极反应式为________。乙池中的总反应离子方程式为_______________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2_______mL(标准状况下)。
II. (4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。

图I 图II
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 用电子式表示HCl的形成过程:![]()
B. ![]() Ho中的原子核内的中子数与核外电子数之差是99
Ho中的原子核内的中子数与核外电子数之差是99
C. 在空气中加热金属锂:4Li+O2![]() 2Li2O
2Li2O
D. Na2O2与H2O2中所含的化学键类型不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
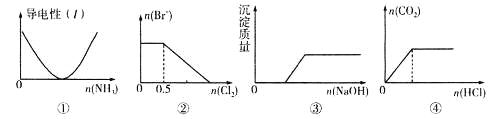
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
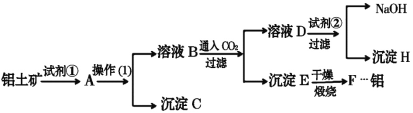
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)写出D的元素符号_________,E的最高价氧化物的水化物的分子式__________。
(2)画出B元素的简单离子结构示意图_____________。
(3)若构成F元素的一种核素的中子数为18,写出该核素的表示符号_____________。
(4)C与F元素最高价氧化物的水化物反应的离子方程式依次为:_____________。
(5)单质C在高温条件下能与氧化铁反应,该反应常用做于焊接铁轨,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是
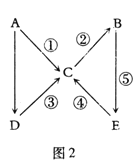
A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com