
ĄŸÌâÄżĄżI.ÈçÍŒÊÇÒ»žö»ŻŃ§čęłÌ”ÄÊŸÒâÍŒĄŁÒŃÖȘŒŚłŰ”ÄŚÜ·ŽÓŠÊœÎȘ2CH3OH+3O2+4KOH=2K2CO3+6H2O

Çë»ŰŽđŁș
(1)ŒŚłŰÊÇ________ŁŹÍšÈëO2”Ĕ猫ŚśÎȘ________Œ«ŁŹ”猫·ŽÓŠÊœÎȘ_____________ĄŁ
(2)ÒÒłŰÊÇ________ŁŹA”猫ĂûłÆÎȘ________Œ«ŁŹ”猫·ŽÓŠÊœÎȘ________ĄŁÒÒłŰÖДČܷŽÓŠÀëŚÓ·œłÌÊœÎȘ_______________________________ŁŹÈÜÒș”ÄpH________(ÌÔöŽóĄ±ĄąĄ°ŒőĐĄĄ±»òĄ°Č»±äĄ±)ĄŁ
(3)”±ÒÒłŰÖĐB(Ag)Œ«”ÄÖÊÁżÔöŒÓ5.40gʱŁŹŒŚłŰÖĐÀíÂÛÉÏÏûșÄO2_______mL(±êŚŒŚŽżöÏÂ)ĄŁ
II. (4)ÍŒIÊÇÓĂÊłŃÎËźŚś”çœâÒș”çœâŃÌÆűÍŃ”Ș”ÄÒ»ÖÖÔÀíÍŒŁŹNO±»ŃôŒ«ČúÉú”ÄŃő»ŻĐÔÎïÖÊŃő»ŻÎȘNO3-ŁŹÎČÆűŸÇâŃő»ŻÄÆÈÜÒșÎüÊŐșóÔÙĆĆÈëżŐÆűÖĐĄŁ”çÁśĂܶÈșÍÈÜÒșpH¶ÔŃÌÆűÍŃ”Ș”ÄÓ°ÏìÈçÍŒIIĄŁ

ÍŒI ÍŒII
ąÙŽŠÀíșó”ÄÎČÆűÖĐŁŹÒ»¶šșŹÓĐ”ÄÆűÌ攄ÖÊÊÇ___________ŁšÌî»ŻŃ§ÊœŁ©ĄŁ
ąÚÈÜÒș”ÄpH¶ÔNOłęÈ„ÂÊÓĐÓ°Ïì”ÄÔÒòÊÇ___________ĄŁ
ĄŸŽđ°žĄżÔ”çłŰ Őę O2Ł«2H2OŁ«4eŁ=4OHŁ ”çœâłŰ Ńô 4OHŁŁ4eŁ=O2ĄüŁ«2H2O 4AgŁ«Ł«2H2O![]() 4AgŁ«O2ĄüŁ«4HŁ« ŒőĐĄ 280 H2 ŽÎÂÈËáÄÆÔÚËáĐÔÌőŒțÏÂŃő»ŻĐÔÔöÇż
4AgŁ«O2ĄüŁ«4HŁ« ŒőĐĄ 280 H2 ŽÎÂÈËáÄÆÔÚËáĐÔÌőŒțÏÂŃő»ŻĐÔÔöÇż
ĄŸœâÎöĄż
Łš1Ł©ŒŚÎȘÔ”çłŰŁŹÍšÈëŃőÆű”ÄÒ»Œ«ÎȘÔ”çłŰ”ÄŐęŒ«ŁŹ·ąÉú»čÔ·ŽÓŠŁŹ”猫·œłÌÊœÎȘO2+2H2O+4e-šT4OH-Ł»
Žđ°žŁșÔ”çłŰŁ»ŐꣻO2+2H2O+4e-šT4OH-Ł»
Łš2Ł©ÒÒÎȘ”çœâłŰŁŹAÓëÔ”çłŰŐęŒ«ÏàÁŹŁŹÎȘ”çœâłŰ”ÄŃôŒ«ŁŹ·ąÉúŃő»Ż·ŽÓŠŁŹ”猫·œłÌÊœÎȘ4OH--4e-šTO2Ąü+2H2OŁŹ”çœâÏőËáÒűÈÜÒșŁŹŃôŒ«ÉúłÉŃőÆűŁŹÒőŒ«ÉúłÉÒűŁŹ”çœâŚÜ·ŽÓŠÊœÎȘ4AgŁ«Ł«2H2O![]() 4AgŁ«O2ĄüŁ«4HŁ«ŁŹÉúłÉH+ŁŹÔòÈÜÒșpHŒőĐĄŁ»
4AgŁ«O2ĄüŁ«4HŁ«ŁŹÉúłÉH+ŁŹÔòÈÜÒșpHŒőĐĄŁ»
Žđ°žŁș”çœâłŰŁ»ŃôŁ»4OH--4e-šTO2Ąü+2H2OŁ»4AgŁ«Ł«2H2O![]() 4AgŁ«O2ĄüŁ«4HŁ« Ł»ŒőĐĄ
4AgŁ«O2ĄüŁ«4HŁ« Ł»ŒőĐĄ
Łš3Ł©ÒÒłŰÖĐBŒ«·ąÉú»čÔ·ŽÓŠŁŹ”猫·œłÌÊœÎȘAg++e-=AgŁŹnŁšAgŁ©=![]() =0.05molŁŹÔòŚȘÒÆ”çŚÓ0.05molŁŹÓɔ猫·œłÌÊœO2+2H2O+4e-šT4OH-żÉÖȘÏûșÄ
=0.05molŁŹÔòŚȘÒÆ”çŚÓ0.05molŁŹÓɔ猫·œłÌÊœO2+2H2O+4e-šT4OH-żÉÖȘÏûșÄ![]() =0.0125molŃőÆűŁŹÔòVŁšO2Ł©=0.0125molĄÁ22.4L/mol=0.28L=280mLŁ»
=0.0125molŃőÆűŁŹÔòVŁšO2Ł©=0.0125molĄÁ22.4L/mol=0.28L=280mLŁ»
Žđ°žŁș280
II. (4)žùŸĘÌâÒâżÉÖȘŁș 2NaCl+2H2O![]() 2NaOH+H2Ąü+Cl2ĄüŁŹ3Cl2+8OH-+2NO=2NO3Ł+4H2O +6ClŁŁŹŽŠÀíșó”ÄÎČÆűÖĐŁŹÒ»¶šșŹÓĐ”ÄÆűÌ攄ÖÊÊÇH2ŁŹžùŸĘÍŒÏóżÉÖȘŁŹpHÔœĐĄŁŹÈ„łęÂÊÔœžßŁŹŐâÊÇÒòÎȘŽÎÂÈËáÄÆÔÚËáĐÔÌőŒțÏÂŃő»ŻĐÔÔöÇżŁ»
2NaOH+H2Ąü+Cl2ĄüŁŹ3Cl2+8OH-+2NO=2NO3Ł+4H2O +6ClŁŁŹŽŠÀíșó”ÄÎČÆűÖĐŁŹÒ»¶šșŹÓĐ”ÄÆűÌ攄ÖÊÊÇH2ŁŹžùŸĘÍŒÏóżÉÖȘŁŹpHÔœĐĄŁŹÈ„łęÂÊÔœžßŁŹŐâÊÇÒòÎȘŽÎÂÈËáÄÆÔÚËáĐÔÌőŒțÏÂŃő»ŻĐÔÔöÇżŁ»
Žđ°žŁșH2 Ł»ŽÎÂÈËáÄÆÔÚËáĐÔÌőŒțÏÂŃő»ŻĐÔÔöÇżĄŁ


 È«ÄÜÁ·żŒŸíÏ”ÁĐŽđ°ž
È«ÄÜÁ·żŒŸíÏ”ÁĐŽđ°ž
| Äꌶ | žßÖĐżÎłÌ | Äꌶ | łőÖĐżÎłÌ |
| žßÒ» | žßÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ | łőÒ» | łőÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ |
| žß¶ț | žß¶țĂâ·ŃżÎłÌÍÆŒöŁĄ | łő¶ț | łő¶țĂâ·ŃżÎłÌÍÆŒöŁĄ |
| žßÈę | žßÈęĂâ·ŃżÎłÌÍÆŒöŁĄ | łőÈę | łőÈęĂâ·ŃżÎłÌÍÆŒöŁĄ |
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÏÂÍŒÎȘÊ”ŃéÊÒÖÆÈĄÉÙÁżÒÒËáÒÒő„”ÄŚ°ÖĂÍŒĄŁÏÂÁĐčŰÓÚžĂÊ”Ńé”ÄĐđÊöÖĐŁŹČ»ŐęÈ·”ÄÊÇ(ĄĄĄĄ)

A. ÏòaÊÔčÜÖĐÏÈŒÓÈëĆšÁòËáŁŹÈ»șó±ßÒĄ¶ŻÊÔčܱßÂęÂęŒÓÈëÒÒŽŒŁŹÔٌӱùŽŚËá
B. ÊÔčÜbÖĐ”ŒÆűčÜ϶ËčÜżÚČ»ÄÜœțÈëÒșĂæ”ÄÔÒòÊÇ·ÀÖčÊ”ŃéčęłÌÖĐ·ąÉú”čÎüÏÖÏó
C. Ê”ŃéʱŒÓÈÈÊÔčÜa”ÄÄż”ÄÊÇŒÓżì·ŽÓŠËÙÂÊČąŒ°Ê±œ«ÒÒËáÒÒő„Őôłö
D. ÊÔčÜbÖб„șÍNa2CO3ÈÜÒș”ÄŚśÓĂÊÇÎüÊŐËæÒÒËáÒÒő„Őôłö”ÄÉÙÁżÒÒËáșÍÒÒŽŒ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżAĄąBĄąCĄąW ŸùÎȘÖĐѧłŁŒû”ÄŽżŸ»ÎïŁŹËüĂÇÖźŒäÓĐÈçÏÂŚȘ»ŻčŰÏ”(ÆäËüČúÎ·ŽÓŠÌőŒțÒŃÂÔÈ„)ĄŁ
![]()
(1)Èô”„ÖÊ A ÎȘ»ÆÉ«čÌÌ棏B ÎȘÎȚÉ«ÓĐŽÌŒ€ĐÔÆűζ”ÄÆűÌ棏C ÄÜÓëËź·ŽÓŠÉúłÉÒ»ÖÖ¶țÔȘÇżËá.
ąÙBĄúC ”Ä»ŻŃ§·œłÌÊœ_____ĄŁ
ąÚÏò NaOH ÈÜÒșÖĐÍšÈëčęÁż”ÄÆűÌć B ”ÄÀëŚÓ·œłÌÊœ______ĄŁ
(2)Èô A ÊÇÒ»ÖÖ»ÆÂÌÉ«”ÄÆűÌ棏B ”ı„șÍÈÜÒș”ÎÈë·ĐËźÖĐÄÜÉúłÉșìșÖÉ«œșÌ楣
ąÙŒìŃé B ÈÜÒșÖĐŃôÀëŚÓ”ÄłŁÓĂÊÔŒÁÊÇ_____ĄŁ
ąÚB Óë W ŚȘ»ŻÎȘ C ”ÄÀëŚÓ·ŽÓŠ·œłÌÊœ_____ĄŁ
ąÛÒ»¶šÌőŒțÏ W ÓëËź·ŽÓŠ”Ä»ŻŃ§·œłÌÊœ______ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÔÚĂܱŐÈĘÆśÖĐŁŹm A(g)+n B(g) ![]() p C(g)·ŽÓŠŽïÆœșâʱŁŹČâ”Ă c(A)ÎȘ 0.5molL1ŁŹÎ¶ÈČ»±ä”ÄÇéżöÏÂŁŹœ«ÈĘÆśÌć»ęÔöŽóÒ»±¶ŁŹ”±Žï”œĐ”ÄÆœșâʱŁŹČâ”Ă c(A)ÎȘ 0.3molL1ŁŹÔòÏÂÁĐĆжÏÖĐŐęÈ·”ÄÊÇ
p C(g)·ŽÓŠŽïÆœșâʱŁŹČâ”Ă c(A)ÎȘ 0.5molL1ŁŹÎ¶ÈČ»±ä”ÄÇéżöÏÂŁŹœ«ÈĘÆśÌć»ęÔöŽóÒ»±¶ŁŹ”±Žï”œĐ”ÄÆœșâʱŁŹČâ”Ă c(A)ÎȘ 0.3molL1ŁŹÔòÏÂÁĐĆжÏÖĐŐęÈ·”ÄÊÇ
A. ÆœșâÏòŐę·ŽÓŠ·œÏòÒƶŻ B. ÎïÖÊB”ÄŚȘ»ŻÂÊŒőĐĄ
C. m + n <p D. ÎïÖÊC”ÄÌć»ę·ÖÊęÔöŒÓ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżąń.żŰÖƱäÁż·šÊÇ»ŻŃ§Ê”Ńé”ÄÒ»ÖÖłŁÓĂ·œ·šĄŁÏ±íÊÇÄłŃ§Ï°ĐĄŚéŃĐŸż”ÈÎïÖÊ”ÄÁżĆš¶È”ÄÏĄÁòËáșÍĐż·ŽÓŠ”ÄÊ”ŃéÊęŸĘŁŹ·ÖÎöÒÔÏÂÊęŸĘŁŹ»ŰŽđÏÂÁĐÎÊÌâŁș
ĐòșĆ | ÁòËá”ÄÌć»ę/mL | Đż”ÄÖÊÁż/g | Đż”ÄĐÎŚŽ | ζÈ/Ąæ | ÍêÈ«ÈÜÓÚËá”ÄʱŒä/s | ÉúłÉÁòËáĐż”ÄÖÊÁż/g |
1 | 50.0 | 2.0 | ±ĄÆŹ | 25 | 100 |
|
2 | 50.0 | 2.0 | żĆÁŁ | 25 | 70 |
|
3 | 50.0 | 2.0 | żĆÁŁ | 35 | 35 |
|
4 | 50.0 | 2.0 | ·ÛÄ© | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | ·ÛÄ© | 35 | 30 |
|
(1)±ŸÊ”ŃéÖĐÊ”Ńé2șÍÊ”Ńé3±íĂś______________________________¶Ô·ŽÓŠËÙÂÊÓĐÓ°ÏìĄŁ
(2)ÈôČÉÓĂÓëÊ”Ńé1ÍêÈ«ÏàÍŹ”ÄÌőŒțŁŹ”«Ïò·ŽÓŠÈĘÆśÖĐ”ÎŒÓÉÙÁżÁòËáÍÈÜÒșŁŹ·ąÏÖ·ŽÓŠËÙÂÊĂśÏÔŒÓżìĄŁÔÒòÊÇ________________________________________________ĄŁ
ąò.ijζÈʱŁŹÔÚ5L”ÄÈĘÆśÖĐŁŹXĄąYĄąZ ÈęÖÖÆűÌć”ÄÎïÖÊ”ÄÁżËæʱŒä”ı仯ÇúÏßÈçÍŒËùÊŸĄŁÇëÍščęŒÆËă»ŰŽđÏÂÁĐÎÊÌâŁș

(3)·ŽÓŠżȘÊŒÖÁ2 minŁŹY”ÄÆœŸù·ŽÓŠËÙÂÊ_______molĄ€L-1min-1 ĄŁ
(4)·ŽÓŠżȘÊŒÖÁ2 minŁŹX”ÄŚȘ»ŻÂÊ________ĄŁ
(5)ĐŽłö XĄąYĄąZ ”Ä·ŽÓŠ·œłÌÊœ__________________________________________ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄż¶ÌÖÜÆÚÖśŚćÔȘËŰAĄąBĄąCĄąDĄąE”ÄÔŚÓĐòÊęÒÀŽÎÔöŽóŁŹÆäÖĐAĄąDÍŹÖśŚćŁŹBĄąCĄąDĄąEÍŹÖÜÆÚŁŹAԌӔČîÍâČă”çŚÓÊęÊÇŽÎÍâČă”çŚÓÊę”Ä3±¶ŁŹBÊǶÌÖÜÆÚÔȘËŰÖĐÔŚÓ°ëŸ¶ŚîŽó”ÄÖśŚćÔȘËŰŁŹCÔŚÓ”ÄÖÊŚÓÊę±ÈBÔŚÓ”ÄÖÊŚÓÊę¶à2žöĄŁÇë»ŰŽđÏÂÁĐÎÊÌâŁș
Łš1Ł©BÔȘËŰ”ÄĂûłÆÎȘ___________ŁŹE”ÄÔȘËŰ·ûșĆÎȘ___________
Łš2Ł©AĄąBÁœÖÖÔȘËŰżÉĐγɻŻŃ§ÊœÎȘB2AĄąB2A2”È»ŻșÏÎïŁŹÔòB2A2”Ä”çŚÓÊœÎȘ_____ĄŁ
Łš3Ł©œ«B2A2ͶÈ딜B2D”ÄËźÈÜÒșÖĐżÉÉúłÉD”Ä”„ÖÊŁŹ·ąÉú·ŽÓŠ”ÄÀëŚÓ·œłÌÊœÎȘŁș______________________
Łš4Ł©DA2ÓëEÔȘË۔Ĕ„ÖÊÔÚËźÖĐ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœÎȘŁș____________________ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżŁš1Ł©ÔÚMnO2+4HCl![]() MnCl2+2H2O+Cl2Ąü·ŽÓŠÖĐĄŁ
MnCl2+2H2O+Cl2Ąü·ŽÓŠÖĐĄŁ
ąÙ__ÔȘË۱»Ńő»ŻŁŹ__ÊÇŃő»ŻŒÁĄŁ
ąÚ__ÊÇŃő»ŻČúÎïŁŹ__·ąÉúŃő»Ż·ŽÓŠĄŁ
ąÛÓĂĄ°Ë«ÏßÇĆĄ±·š±êĂś”çŚÓŚȘÒƔķœÏòșÍÊęÄż__ĄŁ
ąÜČΌӷŽÓŠ”ÄÂÈ»ŻÇâșͱ»Ńő»Ż”ÄÂÈ»ŻÇâ”ÄÎïÖÊ”ÄÁżÖź±È__ĄŁ
Łš2Ł©ÏÖÓĐmgÄłÆűÌ棏ËüÊÇÈęÔŚÓ·ÖŚÓŁŹÆäÄŠ¶ûÖÊÁżÎȘMgĄ€mol-1ĄŁÈô°ą·üŒÓ”ÂÂȚłŁÊęÓĂNA±íÊŸŁŹÇëÓĂÒÔÉÏ·ûșĆŒ°ÏàÓŠÊęŚÖÌîĐŽÏÂÁĐżŐžńĄŁ
ąÙžĂÆűÌć”ÄÎïÖÊ”ÄÁżÎȘ__molĄŁ
ąÚžĂÆűÌćËùșŹÔŚÓŚÜÊęÎȘ___žöĄŁ
ąÛžĂÆűÌćÔÚ±êŚŒŚŽżöÏ”ÄÌć»ęÎȘ__LĄŁ
ąÜžĂÆűÌćÍêÈ«ÈÜÓÚËźĐÎłÉVLÈÜÒș(Č»żŒÂÇ·ŽÓŠ)ŁŹËù”ĂÈÜÒș”ÄÎïÖÊ”ÄÁżĆš¶È__molĄ€L-1ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżŁš1Ł©ÒÔŒŚÍ饹ŃőÆűÎȘÔÁÏŁŹKOHÈÜÒșŚśÎȘ”çœâÖÊččłÉÈŒÁÏ”çłŰŁŹŚÜ·ŽÓŠÊœÎȘ____ŁŹÈçčûÒÔžĂÈŒÁÏ”çłŰÎȘ”çÔŽŁŹÊŻÄ«ŚśÁœŒ«”çœâ±„șÍÊłŃÎËźŁŹÔòžĂ”çœâčęłÌÖĐŃôŒ«”Ĕ猫·ŽÓŠÊœÎȘŁș____Ł»Èçčû”çœâÒ»¶ÎʱŒäșóNaC1ÈÜÒș”ÄÌć»ęÎȘ1LŁŹÈÜÒșÖĐ”ÄOH©ÎïÖÊ”ÄÁżĆš¶ÈÎȘ0.01molL©1Łš25ĄæÏÂČ⶚Ł©ŁŹÔòÀíÂÛÉÏÏûșÄŃőÆű”ÄÌć»ęÎȘ____mLŁš±êżöÏÂŁ©ĄŁ
Łš2Ł©ÓĂČŹ”猫”çœâCuSO4ÈÜÒșŁŹ”±CŁšCu2+Ł©œ”ÖÁÔÀŽ”ÄÒ»°ëÊ±ÍŁÖčÍš”磏ÔòŒÓÈëÏÂÁĐÎïÖÊÖĐ”Ä__ ŁšÌîĐòșĆŁ©ÎïÖÊÄÜÊčÈÜÒș»ÖžŽłÉÔÀŽĆš¶ÈŁ»
AŁźCuO BŁźCuŁšOHŁ©2 CŁźCu DŁźH2O
”çœâșó”çœâÖÊÈÜÒș”ÄpHÖ”__ŁšÌÔöŽóĄ±Ą°ŒőĐĄĄ±»òĄ°Č»±äĄ±Ł©Ł»ĐŽłö”çœâŚÜÀëŚÓ·œłÌÊœ____ĄŁ
Łš3Ł©ÓĂPtŚś”猫”çœâÏőËáÒűÈÜÒșŁŹÈçÍŒŒŚËùÊŸŁŹÔòŚó±ßPt”猫ĂûłÆÊÇ__Ł»·ąÉú”Ĕ猫·ŽÓŠÊœÎȘ__ĄŁ
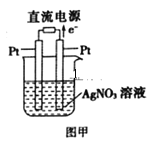
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄż1mol H2ÈŒÉŐÉúłÉÒșÌŹËźÊ±·Ćłö285.8kJ ÈÈÁżŁŹÏÂÁбíÊŸžĂ·ŽÓŠ”ÄÈÈ»ŻŃ§·œłÌÊœŐęÈ·”ÄÊÇ
A. 2H2(g)+O2(g)=2H2O(l) ĄśH =-142.9kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) ĄśH =+571.6 kJ/mol
C. 2H2(g)+O2(g)=2H2O(l) ĄśH =-57l.6 kJ/mol
D. 2H2+O2=2H2O ĄśH =-571.6kJ/mol
Č鿎Žđ°žșÍœâÎö>>
čúŒÊѧУÓĆŃĄ - Á·Ï°ČáÁбí - ÊÔÌâÁбí
șț±±ÊĄ»„ÁȘÍű΄·šșÍČ»ÁŒĐĆÏąŸÙ±šÆœÌš | ÍűÉÏÓĐșŠĐĆÏąŸÙ±šŚšÇű | ”çĐĆŐ©ÆŸÙ±šŚšÇű | ÉæÀúÊ·ĐéÎȚÖśÒćÓĐșŠĐĆÏąŸÙ±šŚšÇű | ÉæÆóÇÖÈšŸÙ±šŚšÇű
΄·šșÍČ»ÁŒĐĆÏąŸÙ±š”ç»°Łș027-86699610 ŸÙ±šÓÊÏäŁș58377363@163.com