
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
【答案】NO2-+H2O![]() HNO2+OH- c(OH-)-c(H+) 大于 c(NO2-)>c(Na+)>c(H+)>c(OH-) 小于 小于
HNO2+OH- c(OH-)-c(H+) 大于 c(NO2-)>c(Na+)>c(H+)>c(OH-) 小于 小于
【解析】
(1)NO2-发生了水解,显碱性,因而pH>7,其离子方程式为NO2-+H2O![]() HNO2+OH-,根据NaNO2溶液质子守恒,可得c(H+)+c(HNO2)=c(OH-),因而c(HNO2)= c(OH-)- c(H+)。
HNO2+OH-,根据NaNO2溶液质子守恒,可得c(H+)+c(HNO2)=c(OH-),因而c(HNO2)= c(OH-)- c(H+)。
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,得到等浓度的HNO2和NaNO2的混合液,所得溶液的pH<7,说明HNO2的电离程度大于NO2-的水解程度。HNO2的电离程度较大,得到较多的NO2-,因而其浓度大于Na+的浓度,溶液显酸性,说明c(H+)>c(OH-),另外水解和电离是微弱的,可知Na+的浓度大于H+的浓度,因而c(NO2-)>c(Na+)>c(H+)>c(OH-)。
(3)常温下,pH=3的HNO2溶液,因HNO2是弱酸,c(HNO2)>10-3mol/L,pH=11的NaOH溶液,c(NaOH)=10-3mol/L,等体积混合,易知酸过量,因而溶液显酸性,pH<7,根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+ c(NO2-),c(H+)>c(OH-),所以c(Na+)< c(NO2-)。


科目:高中化学 来源: 题型:
【题目】(1)以甲烷、氧气为原料,KOH溶液作为电解质构成燃料电池,总反应式为____,如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:____;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH﹣物质的量浓度为0.01molL﹣1(25℃下测定),则理论上消耗氧气的体积为____mL(标况下)。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__ (填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D.H2O
电解后电解质溶液的pH值__(填“增大”“减小”或“不变”);写出电解总离子方程式____。
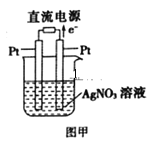
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Pt电极名称是__;发生的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol H2燃烧生成液态水时放出285.8kJ 热量,下列表示该反应的热化学方程式正确的是
A. 2H2(g)+O2(g)=2H2O(l) △H =-142.9kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H =+571.6 kJ/mol
C. 2H2(g)+O2(g)=2H2O(l) △H =-57l.6 kJ/mol
D. 2H2+O2=2H2O △H =-571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
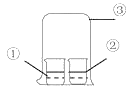
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、A1(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断中不合理的是( )
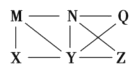
A. N一定是HCl(aq)B. X可能是Al或Cl2
C. Q、Z中的一种必定为A12O3D. Y一定为NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
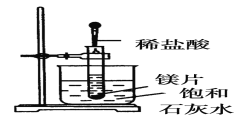
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
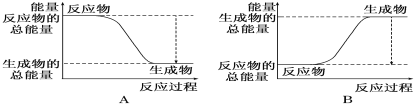
(1)如图能正确表示该反应中能量变化的是_________。
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关的说法正确的是( )
(Ⅰ)![]() (Ⅱ)
(Ⅱ)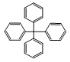
A. Ⅰ分子中碳原子不可能都在同一平面上B. Ⅱ分子中所有碳原子有可能处于同一平面
C. Ⅰ有7个碳原子可能在同一直线上D. Ⅰ只可能有5个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com