
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是
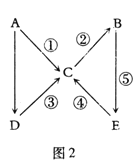
A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
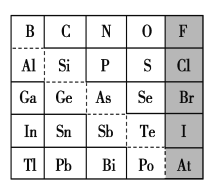
(1)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(2)元素Ga在元素周期表中的位置为:______________。
(3)根据元素周期律,推断:
①阴影部分元素的氢化物热稳定性最高的是________(填化学式)。
②N、O、Al、Si,原子半径大小顺序:___________________
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:______________
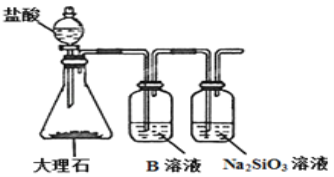
(4)为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用 ___________溶液,作用是___________________,能说明C和Si非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫和二氧化氮叙述正确的是( )
A.两种气体都是有毒的气体,且都可用水吸收以消除对空气的污染
B.两种气体都具有强氧化性,因此都能够使品红溶液褪色
C.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸
D.两种气体溶于水都可以与水反应,且只生成相应的酸,大气中的 NO2 和 SO2 可以形成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列关于该有机物的描述不正确的是
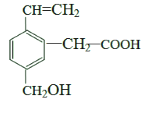
①所有碳原子可能共面;
②能使酸性KMnO4溶液和溴水褪色,且原理相同;
③1mol该有机物分别与足量Na或NaHCO3反应,产生气体在相同条件下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol该有机物完全燃烧生成CO2和H2O消耗O2的体积为280 L(标准状况)
A. ①②B. ②⑥C. ③⑥D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
B. 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸钠溶液中红色更深,证明阴离子水解常数Kh: CO32->HCO3-
C. 含0.2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为0.3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 向装有Fe(NO3)2溶液的试管中加入稀硫酸 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D | SO2和SO3混合气体通入Ba(NO3)2溶液 | 出现白色沉淀 | 得到的沉淀只有BaSO4 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com