
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
【答案】2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2 除去氯气中混有的HCl d e j h (b c) g f 吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解 2Cu2++2Cl+SO2+2H2O=2CuCl↓+4H++SO42- 温度不能过低,防止反应速率慢;不能过高,过高HCl挥发 溶液由蓝色变为无色 稀释促进平衡CuCl(白色)+2Cl![]() [CuCl3]2(无色溶液)逆向移动,生成CuCl
[CuCl3]2(无色溶液)逆向移动,生成CuCl
【解析】
I.(1)装置A中高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰、水;氯气难溶于饱和食盐水,氯化氢易溶于饱和食盐水;
(2)用干燥、纯净的氯气制备氯化铜,实验顺序是氯气制取、除杂、干燥、与铜反应、尾气处理;
(3)装置D中的碱石灰可以吸收氯气、水蒸气;
Ⅱ. 氯化铜溶液中通入SO2,氯化铜被还原为CuCl,SO2被氧化为硫酸;
(1)温度过低,反应速率慢;温度过高, HCl易挥发。CuSO4溶液呈蓝色、[CuCl3]2-呈无色;
(2)加水稀释CuCl(白色)+2Cl![]() [CuCl3]2平衡逆向移动。
[CuCl3]2平衡逆向移动。
I.(1)装置A中,高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰、水,发生反应的化学反应方程式为:2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2;氯气难溶于饱和食盐水,氯化氢易溶于饱和食盐水,所以装置C中装有饱和食盐水的作用是除去氯气中混有的HCl;
(2)从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后用碱石灰处理尾气,则依次再通过b c g f,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→b→c →g→f;
(3)D装置中装有碱石灰,其作用是吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解;
Ⅱ. 向制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,同时生成硫酸,反应的离子方程式为:2Cu2++2Cl+SO2+2H2O=2CuCl↓+4H++SO42-;
(1)温度不能过低,防止反应速率慢;不能过高,过高HCl挥发,故①中“加热”温度不宜过高和过低;当观察到溶液由蓝色变为无色,即表明反应已经完全;
(2)②中,加入大量水的作用是稀释促进平衡CuCl(白色)+2Cl![]() [CuCl3]2逆向移动,生成CuCl沉淀。
[CuCl3]2逆向移动,生成CuCl沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
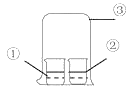
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A分子由C、H、O三种元素组成,其相对分子质量为120,0.1molA在足量的氧气中充分燃烧后生成0.8mol CO2 和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A的分子式是_________,A中含氧官能团的名称是________________,A的结构简式是_______________。
已知:I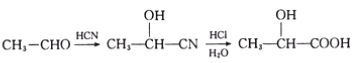
II.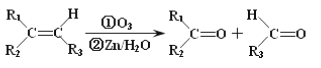
现有如下转化关系:
![]()
其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质是____________。(请填字母)
① 能与H2发生加成反应;② 能在碱性溶液中发生水解反应;③ 能与甲酸发生酯化反应;④ 能与Ag(NH3) 2OH溶液发生银镜反应;⑤能与氢氧化钠溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3)① 写出C→D的化学反应方程式是________________________________________;反应类型是____________。
②在催化剂条件下,C生成高聚物的化学方程式是_________________________________。
(4)请写出化合物C可能的同分异构体结构简式是___________________________。须同时符合下列条件:
①属于酯类化合物;
②遇三氯化铁溶液显紫色;
③与新制氢氧化铜悬浊液共热可生成红色沉淀;
④苯环上的一卤代物只有一种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对浓硫酸与木炭反应探究。
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是___。
(2)试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号)(_____)→(②)→(_____)→(_____)。
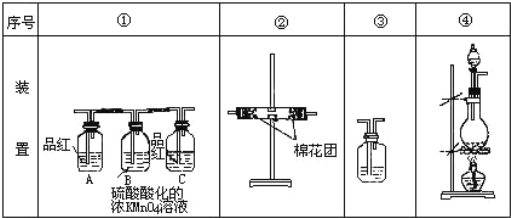
(3)实验时可观察到装置①中A瓶现象___,C瓶现象___,B瓶溶液的作用是___。
(4)装置②中所加的固体药品是___。
(5)装置③中所盛溶液是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格的不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成线路。

请回答下列问题:
(1)写出反应类型:反应①______________,反应②__________________。
(2)写出结构简式:PVC________________,C______________________。
(3)写出A![]() D的化学方程式_______________________________。
D的化学方程式_______________________________。
(4)与D互为同分异构体且可发生碱性水解的物质有________种(不包括环状化合物),写出其中一种的结构简式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A + 3B![]() 2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
A. (2)>(4)>(3)>(1) B. (1)>(4)>(2)= (3)
C. (4)>(3)=(2)>(1) D. (2)>(3)= (4)>(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有二氧化硫—空气质子交换膜燃料电池,其原理如图所示。下列说法不正确的是
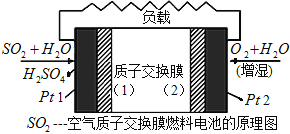
(注:质子指H+,质子交换膜仅允许H+通过)
A. Pt2电极附近发生的反应为:O2+4e-+2H2O=4OH-
B. 该电池工作时质子从Pt1电极经过内电路流到Pt2电极
C. Pt1电极附近发生的反应为:SO2+2H2O-2e-=SO42-+4H+
D. 该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com