
【题目】有关的说法正确的是( )
(Ⅰ)![]() (Ⅱ)
(Ⅱ)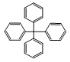
A. Ⅰ分子中碳原子不可能都在同一平面上B. Ⅱ分子中所有碳原子有可能处于同一平面
C. Ⅰ有7个碳原子可能在同一直线上D. Ⅰ只可能有5个碳原子在同一直线上
【答案】D
【解析】
A.乙炔分子是直线结构,可以摆乙炔分子中与苯连接的C原子看作是取代苯分子中H原子的位置,在苯分子的平面上,一条直线上2点在一个平面上,则这条直线上所有的点都在这个平面上,苯分子是平面分子,乙烯分子是平面分子,甲基碳原子取代乙烯分子的H原子的位置在乙烯分子的平面上,苯分子平面与乙烯分子的平面可以共平面,所有I分子中所有C原子可能在同一平面上,A错误;
B.Ⅱ分子中与 4个苯环连接的C原子属于饱和C原子,故Ⅱ分子与甲烷有相似的结构特点,因此不可能所有的C原子在同一平面上,B错误;
C.苯分子中在六元环对位上的C原子在同一条直线上,乙炔分子是直线型分子,乙炔分子中与苯环连接的C原子取代苯分子中H原子的位置,在该直线上,乙烯分子中与苯环连接的C原子取代苯环上H原子的位置,在对位C原子的直线上,因此I中有5个C原子在同一条直线上,C错误;
D.通过选项C分析可知在同一条直线上最多有5个C原子,D正确;
故合理选项是D。


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)写出D的元素符号_________,E的最高价氧化物的水化物的分子式__________。
(2)画出B元素的简单离子结构示意图_____________。
(3)若构成F元素的一种核素的中子数为18,写出该核素的表示符号_____________。
(4)C与F元素最高价氧化物的水化物反应的离子方程式依次为:_____________。
(5)单质C在高温条件下能与氧化铁反应,该反应常用做于焊接铁轨,请写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称________、________、________。
(2)C在元素周期表中的位置是____________________。
(3)B的原子结构示意图为________________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径A________C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为____,中心原子的杂化形式为______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为_________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为_________。
(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_____,提供孤电子对的成键原子是__________
③氨的沸点____(填“高于”或“低于”)膦(PH3),原因是______。氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
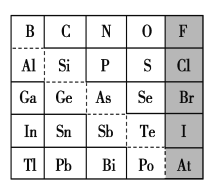
(1)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(2)元素Ga在元素周期表中的位置为:______________。
(3)根据元素周期律,推断:
①阴影部分元素的氢化物热稳定性最高的是________(填化学式)。
②N、O、Al、Si,原子半径大小顺序:___________________
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:______________
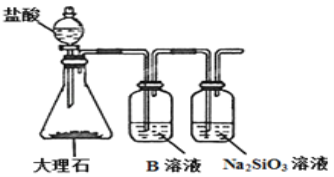
(4)为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用 ___________溶液,作用是___________________,能说明C和Si非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫和二氧化氮叙述正确的是( )
A.两种气体都是有毒的气体,且都可用水吸收以消除对空气的污染
B.两种气体都具有强氧化性,因此都能够使品红溶液褪色
C.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸
D.两种气体溶于水都可以与水反应,且只生成相应的酸,大气中的 NO2 和 SO2 可以形成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
B. 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸钠溶液中红色更深,证明阴离子水解常数Kh: CO32->HCO3-
C. 含0.2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为0.3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:

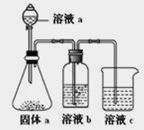
(1)元素B在周期表中的位置___________________________________。
(2)用电子式表示D2G的形成过程_______________________________________________________,其所含化学键类型为_____________。
(3)C2-、D+、G2-离子半径由大到小顺序是________________________(用离子符号回答)。
(4)某同学设计上图实验证明A、F的非金属性强弱关系。
①若溶液a为浓盐酸,固体a为石灰石,溶液 b和c分别为____________________,____________________。
②溶液c中的离子方程式为_______________________________________。
③请从原子结构的角度解释非金属性A>F的原因:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com