
【题目】四氢呋喃 (THF)常用于药物合成,结构如下图,下列关于该化合物的说法错误的是
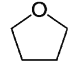
A.二氯代物有五种
B.与丁醛互为同分异构体
C.所有碳原子不能处于同一平面
D.1mol呋喃(![]() )生成1 mol 四氢呋喃需要2 mol H2
)生成1 mol 四氢呋喃需要2 mol H2
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】熔盐级硝酸钠大量应用于太阳能储热介质,一种以工业纯碱(纯度为98%,杂质为NaCl)和生产硝酸产生的NO,废气(含NO、NO2)为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
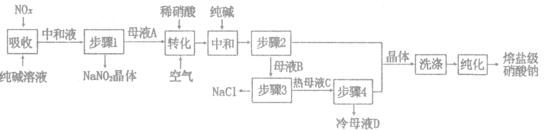
(1)纯碱“吸收”NO、NO2反应的化学方程式为_______________.“中和液”所含溶质除NaCl及少量Na2CO3外,还有___________(填化学式)。
(2)母液A加人稀硝酸生成有NO.写出“转化”时加入稀硝酸反应的离子方程式___________
(3)“洗涤”时可以使用母液___________(填“A”或“B”),晶体"纯化”的方法为___________(填操作名称)。
(4)“步骤3”需要高温分离NaCl固体.原因是_______________,母液D可返回步骤___________(填“2”或“3”)循环使用。
(5)若得到NaNO2、NaNO3两种产品的物质的量之比为2:1,假定Na2CO3恰好完全反应,则生产1.38吨NaNO2时,工业纯碱的理论用量为___________吨(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某未知溶液X中可能含有Mg2+、Cu2+、Fe3+、Fe2+、SO42-、Cl-中的几种,进行如下实验:
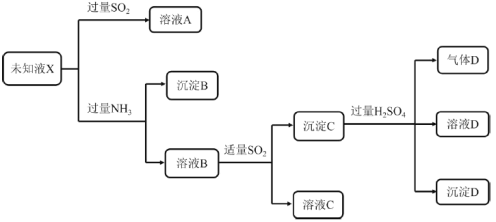
已知:Cu2SO3为白色固体,难溶于水,易溶于稀硫酸。下列说法正确的是
A.未知液X中一定含有Cu2+、Fe3+,可能含有Mg2+
B.溶液B中含有大量的Cu2+
C.取沉淀B加硫酸溶解,再加入KSCN溶液,若显血红色,说明溶液X中一定含有Fe3+
D.沉淀C与稀硫酸发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖已授予约翰·班宁斯特·古迪纳夫、斯坦利·惠廷汉姆和吉野彰,三位科学家的获奖理由是为锂电池的发展做出了卓越贡献。下图是我国一项电解制备金属锂的新方法发明专利装置图。下列说法不正确的是
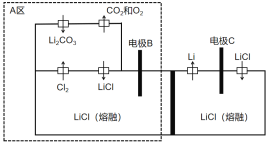
A.电极B的电势比电极C高
B.理论上该装置不需要补充电解质LiCl
C.电极B中氯离子和碳酸根离子放电
D.A区避免熔融碳酸锂对设备的腐蚀且减少了环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
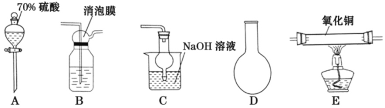
【题目】已知Cu2O在酸性条件下易歧化且2Cu2++4I-=2CuI↓+I2;碘单质易溶于碘化钾形成I3—,I3—极易被碘化亚铜吸附。请搭建合适的装置制备二氧化硫并定性与定量的探究其与氧化铜反应的产物。
(一)探究二氧化硫与氧化铜反应
(1)下列仪器按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):A-D-____。
(2)装置B使用消泡膜的目的是____。
(3)充分反应后,硬质玻璃管中黑色固体变红色,取产物少许,加水后部分固体溶解,溶液呈蓝色,过滤红色沉淀物洗涤干净后,加硫酸溶解后溶液也呈蓝色且仍有少量红色难溶物。写出硬质玻璃管中发生的化学方程式____。
(二)碘量法测定硫酸铜的质量分数。
步骤1:配制并标定Na2S2O3标准溶液,其浓度为a molL—1。
步骤2:取硬质玻璃管产物mg配制为250mL溶液。(Cu2O不溶于水,已过滤掉)
步骤3:取20.00mL溶液,滴加几滴硫酸溶液并加入过量碘化钾溶液,以淀粉溶液作指示剂用硫代硫酸钠标准溶液滴定,消耗体积为VmL,接近终点时加入了硫氰化钾溶液。(I2+2Na2S2O3=Na2S4O6+2NaI)
(4)Na2S2O3溶液需要标定的原因是____,配制该溶液时需要用到的玻璃仪器有试剂瓶、烧杯、____和玻璃棒。
(5)通过上述测定产物中硫酸铜质量分数为____(用含字母的代数式表示),该测定值比实际值____(填“偏小”或“偏大”),原因是____,加入了硫氰化钾溶液的原因可能是____,从而减少实验误差。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2,32.5克的锌与50 mL 18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体VL。将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08 mol/L。
(1)反应过程中消耗的H2SO4的物质的量是________。
(2)气体的成分是______,V为______。
(3)反应过程中转移的电子的物质的量是________。
(4)另取相同浓硫酸,向其中改加铁粉,若逐渐加入a克铁粉,同时加热,最终数据均同上,则a=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4 和 HMCM-22 的表面,以 CO2 为碳源,与电解水产生的 H2 催化转化为高附加值的烃类化合物,其过程如图。
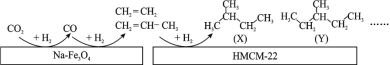
图中 CO2 转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJmol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJmol-1。图中 CO 转化为 C2H4 的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2 合成甲醇,其反应为:CO(g)+2H2(g)CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
该反应速率的通式为 v正=k正 cm(CO)cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______、n =_____(取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 molL-1时达到平衡,请计算该反应的平衡常数 K = _____。
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
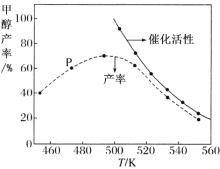
请判断温度为 470 K 时,图中 P 点 _________(填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____、 _____。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
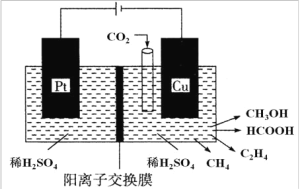
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________。
②如果Cu 电极上只生成 0.15 mol C2H4 和 0.30 mol CH3OH,则 Pt 电极上产生O2 的物质的量为 ___________mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 molL-1 HCOOH 溶液与 0.1 molL-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________(用含 a、b 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化为Fe2+。人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
(2)请按要求正确书写:
①“铁与硫酸铜溶液反应”(离子方程式):__;
②用CO还原Fe2O3(化学方程式):__。
(3)某一反应中有反应物和生成物的粒子共6种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是__(填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子数为__。
③写出该反应的离子方程式(用单线桥法表示出电子的转移方向及数目)__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com