
【题目】熔盐级硝酸钠大量应用于太阳能储热介质,一种以工业纯碱(纯度为98%,杂质为NaCl)和生产硝酸产生的NO,废气(含NO、NO2)为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
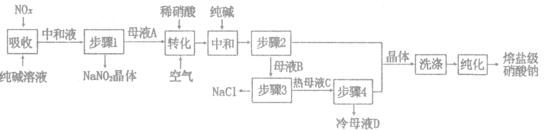
(1)纯碱“吸收”NO、NO2反应的化学方程式为_______________.“中和液”所含溶质除NaCl及少量Na2CO3外,还有___________(填化学式)。
(2)母液A加人稀硝酸生成有NO.写出“转化”时加入稀硝酸反应的离子方程式___________
(3)“洗涤”时可以使用母液___________(填“A”或“B”),晶体"纯化”的方法为___________(填操作名称)。
(4)“步骤3”需要高温分离NaCl固体.原因是_______________,母液D可返回步骤___________(填“2”或“3”)循环使用。
(5)若得到NaNO2、NaNO3两种产品的物质的量之比为2:1,假定Na2CO3恰好完全反应,则生产1.38吨NaNO2时,工业纯碱的理论用量为___________吨(保留3位有效数字)。
【答案】Na2CO3+NO+NO2=2NaNO2+CO2 NaNO2、NaNO3 3NO2-+2H+=NO3-+2NO+H2O B 重结晶 防止NaNO3的析出 3 1.62
【解析】
根据工艺流程图,用纯碱吸收氮氧化合物,反应生成CO2和NaNO2,中和后得到中和液经步骤1得到NaNO2晶体和含有NaNO2的母液A,加入稀硝酸并通入空气进行转换得生成NO和NaNO3,再加入适量的纯碱中和稀硝酸,经步骤2得到含有NaNO3的母液B和NaNO3晶体,母液B经高温分离出NaCl和热母液C,再经步骤4得到含NaNO3的冷母液D和NaNO3晶体,最终经洗涤转化得到熔盐级硝酸钠,据此分析解答。
(1)根据上述分析,用纯碱吸收氮氧化合物,发生反应生成CO2和NaNO2,反应方程式为Na2CO3+NO+NO2=2NaNO2+CO2,“中和液”所含溶质除NaCl及少量Na2CO3外,还含有生成的NaNO2及部分NaNO3,故答案为:Na2CO3+NO+NO2=2NaNO2+CO2;NaNO2、NaNO3;
(2)“转化”过程中,含有NaNO2的母液A加入稀硝酸生成NO和NaNO3,反应的离子方程式为3NO2-+2H+=NO3-+2NO+H2O,故答案为:3NO2-+2H+=NO3-+2NO+H2O;
(3)母液B含有大量的NaNO3,因此在洗涤硝酸钠可适用母液B来进行洗涤,纯化NaNO3晶体时,可采用重结晶的方法,提高晶体的纯度,故答案为:B;重结晶;
(4)NaNO3的溶解度随温度的升高而升高,而NaCl的溶解度随温度变化较小,因此为了防止NaNO3的析出,需要在高温的条件下分离NaCl固体,母液D液含NaNO3,可返回步骤3循环使用,故答案为:防止NaNO3的析出;3;
(4)生产1.38吨NaNO2时,![]() ,已知NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可以知道,n(Na2CO3)=
,已知NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可以知道,n(Na2CO3)=![]() [n(NaNO2)+n(NaNO3)]=1.5×104mol,则m(Na2CO3)=1.5×104mol×106g/mol=1.59×106g,则需要工业纯碱的用量为1.59×106g÷98%≈1.62×106g=1.62t,故答案为:1.62。
[n(NaNO2)+n(NaNO3)]=1.5×104mol,则m(Na2CO3)=1.5×104mol×106g/mol=1.59×106g,则需要工业纯碱的用量为1.59×106g÷98%≈1.62×106g=1.62t,故答案为:1.62。


科目:高中化学 来源: 题型:
【题目】一种新型的电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。用该装置电解过程中产生的羟基自由基(OH)氧化能力极强,能氧化苯酚为CO2、H2O。下列说法错误的是
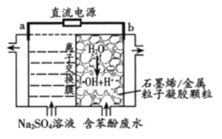
A.阳极电极反应为2H2O—4e-=O2↑+H+
B.H+通过离子交换膜向阴极移动
C.苯酚被氧化的化学方程式为C6H5OH+28OH=6CO2↑+17H2O
D.每转移0.7mole一两极室共产生气体体积为11.2L(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为___________________________________;
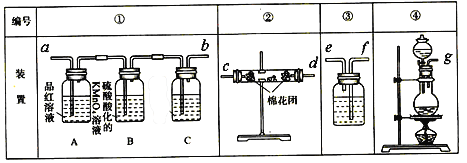
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
____接 ____,____接____,____接 ____。
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色。B瓶中的溶液的作用是____________________;C瓶中所加试剂是___________________。
(4)装置②中所加固体药品是无水硫酸铜,装置③中所加试剂是 _____________;装置④中带活塞的仪器名称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察如图,然后回答问题。
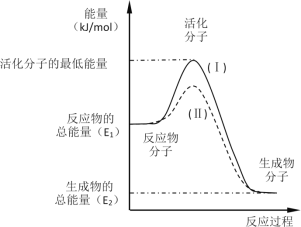
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_________(填“需要”或“不需要”)加热,该反应的△H =___________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g);△H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g)=H2O(g);△H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)已知4克H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:_________
(4)碳燃烧的热化学方程式为: C(s)+O2(g)=CO2(g);△H= -393.5kJ/mol试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___、___、___等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____;
b.实验编号3的实验中KClO3的分解率为____%(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___(填分子式),可用____试纸检验,上述异常现象产生的原因是____;
(5)实验结论:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃 (THF)常用于药物合成,结构如下图,下列关于该化合物的说法错误的是
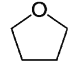
A.二氯代物有五种
B.与丁醛互为同分异构体
C.所有碳原子不能处于同一平面
D.1mol呋喃(![]() )生成1 mol 四氢呋喃需要2 mol H2
)生成1 mol 四氢呋喃需要2 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com