
����Ŀ��ѧϰ��Ԫ�������ɺ�ͬѧ�ǶԵ������ڹ���Ԫ�������������Ũ�����Ȥ���Ƿ�ֻ�ж��������ܴ���������ȷֽ⣿������������ͭ���������ȶ�����ص����ȷֽ���û�д����ã��Դ����ǽ�����ʵ��̽�����������Ҫ��������в���ʵ�鱨�档
��1��ʵ���������Լ���ʵ�������������е�����̨������Ƥ���ĵ��ܡ�����װ�á�����װ�á�������ƽ��ҩ�ס�___��___��___�ȣ�
ʵ���Լ����������̡�������������ͭ��������������أ�
��2��ʵ�鲽�裺�ԣ�
��3��ʵ�����ݣ�
ʵ���� | KClO3������g�� | �����ﻯѧʽ | ������������g�� | ����������� | �������壨mL���������㵽����� | ��ʱ��s�� |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | �쳣 | 67.2 | 188.3 |
��4��ʵ�����ۣ�
a.��������Ļ��չ����У�Ҫ���й��˲��������õIJ��������Dz�������____��
b.ʵ����3��ʵ����KClO3�ķֽ���Ϊ____%(����һλС��)��
c.����Cr2O3���о�ʵ��ʱ�������л���ɫ�̼�����ζ�����������ͬʱ��ɫ�Ļ���������ٻ�ɫ���ô̼���������___(�����ʽ)������____��ֽ���飬�����쳣���������ԭ����____��
��5��ʵ����ۣ�____��
���𰸡����Թ� �ƾ��� ��ʱ��(�����) ��ͨ©�����ձ� 40.8 Cl2 ʪ��ĵ⻯�ص��� KClO3��Cr2O3������������ԭ��Ӧ ������������ͭ���������̵ȶ�����ΪKClO3���ȷֽ�Ĵ������������Ͷ������̵Ĵ������Ϻ�
��������
��1����ʵ��Ϊ���ȹ��������壬�о������ã���Ҫ���㷴Ӧ���ʣ�������Ҫ������Ӧʱ�䣻
��4��a.���ݹ���װ�ûش�
b.����ʵ����3��ʵ�����������������������ֽ�KClO3��������������KClO3�ķֽ��ʣ�
c.����Cr2O3���о�ʵ��ʱ�������л���ɫ�̼�����ζ�����������ͬʱ��ɫ�Ļ���������ٻ�ɫ������ɫ���̼���������������������ʹʪ��ĵ��۵⻯����ֽ��������Ӧ����Ԫ�ػ��ϼ����ߣ�˵��������������ԭ��Ӧ��
��5�����ݱ���ʵ�����ݵó�ʵ����ۡ�
��1����ʵ��Ϊ���ȹ��������壬��Ҫ���������д��Թܡ��ƾ��ƣ���Ҫ������Ӧʱ�䣬����Ҫ��ʱ��(�����)��
��4��a.���ݹ���װ�ã����˲������õIJ��������Dz���������ͨ©�����ձ���
b. ʵ��3���������������ʵ�����0.0672L��22.4L/mol=0.003mol������ݷ���ʽ2KClO3![]() 2KCl+3O2������֪��������ص����ʵ�����0.002mol����������ص�������0.002mol��122.5g/mol��0.245g�� KClO3�ķֽ���=
2KCl+3O2������֪��������ص����ʵ�����0.002mol����������ص�������0.002mol��122.5g/mol��0.245g�� KClO3�ķֽ���=![]() 40.8 %��
40.8 %��
c.����Cr2O3���о�ʵ��ʱ�������л���ɫ�̼�����ζ�����������ͬʱ��ɫ�Ļ���������ٻ�ɫ������ɫ���̼�������������������ʽ��Cl2��������ʹʪ��ĵ��۵⻯����ֽ���������Կ���ʪ��ĵ��۵⻯����ֽ���飬��Ӧ����Ԫ�ػ��ϼ����ߣ�˵��KClO3��Cr2O3������������ԭ��Ӧ��
��5�����ݱ���ʵ�����ݣ�����������������ͭ���������̵�ʵ�鷴Ӧ���ʿ죬������������������ͭ���������̵ȶ�����ΪKClO3���ȷֽ�Ĵ������������Ͷ������̵Ĵ������Ϻá�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A.��ɫ������Һ��Na+��Cu2+��NO3-��Cl-
B.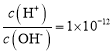 ����Һ��K+��Na+��CO32-��NO3-
����Һ��K+��Na+��CO32-��NO3-
C.ʹ���ȳʺ�ɫ����Һ��Ba2+��NH4+��Cl-��ClO-
D.���ܽ�Al(OH)3����Һ��Na+��NH4+��NO3-��CH3COO-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����μ������ƴ���Ӧ����̫���ܴ��Ƚ��ʣ�һ���Թ�ҵ�������Ϊ98%������ΪNaCl)���������������NO,��������NO��NO2)Ϊԭ�Ϸ����������Ʋ���ȡ���μ������ƵĹ���������ͼ��ʾ���ش��������⣺
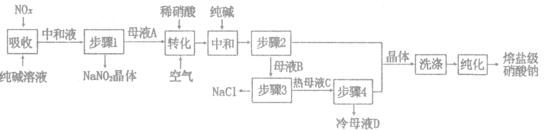
��1��������������NO��NO2��Ӧ�Ļ�ѧ����ʽΪ_______________.���к�Һ���������ʳ�NaCl������Na2CO3�⣬����___________(�ѧʽ����
��2��ĸҺA����ϡ����������NO.д����ת����ʱ����ϡ���ᷴӦ�����ӷ���ʽ___________
��3����ϴ����ʱ����ʹ��ĸҺ___________(����A������B����������"�������ķ���Ϊ___________(��������ƣ���
��4��������3����Ҫ���·���NaCl����.ԭ����_______________��ĸҺD�ɷ��ز���___________(����2������3����ѭ��ʹ�á�
��5�����õ�NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2:1���ٶ�Na2CO3ǡ����ȫ��Ӧ��������1.38��NaNO2ʱ����ҵ�������������Ϊ___________�֣�����3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ���500��600 �����м��ͨ������������ˮ�Ȼ�����������ͼ��ʾ��װ��ģ���������̽���ʵ�顣

��1��д�����������ƣ�a_______��b________��
��2��A�з�Ӧ�Ļ�ѧ����ʽΪ________��C�з�Ӧ�Ļ�ѧ����ʽΪ________��
��3��װ��B�м�����Լ���________��
��4����֪��������м��ͨ���Ȼ����������������ˮ�Ȼ�������Ϊ��ֹ������FeCl2���ɣ�����װ��__��__������ĸ��������һ��ʢ��________��ϴ��ƿ��
��5��װ��D��������________��Ϊ��ֹˮ����Ӱ����ˮ�Ȼ�������ȡ���������һ����װ��D�ĸĽ�������________��
��6����Ӧ������ȡ����װ��C�еĹ������Թ��У������������ᣬ������ȫ�ܽ⣬�õ���ҺX��֤����ҺX�к���FeCl3���Լ���________���۲쵽��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��ͨ����ͼ��ʾʵ��װ�ý��е绯ѧʵ�顣ʵ��������£��ٱպ�S1����S2������20s���ڴ�S1���պ�S2���۲���������˵������ȷ����
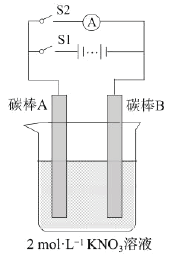
A.������ʱ�缫AΪ����������������Ӧ
B.������ʱ�缫BΪ������������B��Ǩ��
C.������ʱΪ���أ�������ʱΪԭ���
D.ʵ��������������Һ��Ũ�ȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��R�����������0.112g����ˮ�õ�100g������Һ�������ʵ���������Ϊ0.148%����֪��ԭ�Ӻ�����20�����ӣ��Ծ�����������R�Ǻ�Ԫ�ء�____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijδ֪��ҺX�п��ܺ���Mg2����Cu2����Fe3����Fe2����SO42����Cl���еļ��֣���������ʵ�飺
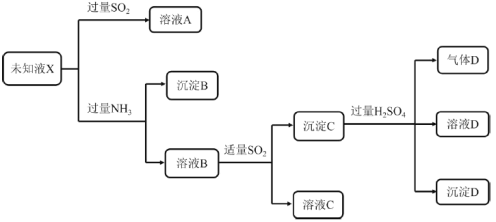
��֪��Cu2SO3Ϊ��ɫ���壬������ˮ��������ϡ���ᡣ����˵����ȷ����
A.δ֪ҺX��һ������Cu2����Fe3�������ܺ���Mg2��
B.��ҺB�к��д�����Cu2��
C.ȡ����B�������ܽ⣬�ټ���KSCN��Һ������Ѫ��ɫ��˵����ҺX��һ������Fe3��
D.����C��ϡ���ᷢ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ��ᣬ�ֳƲ��ᣬͨ���ڿ������ױ����������ʡ��������ӽᾧˮ��H2C2O4��2H2O��ȴ���ڿ������ȶ����ڡ��ڷ�����ѧ�г���H2C2O4��2H2O��KMnO4�ĵζ��������й���H2C2O4��˵����ȷ����
A�������Ƕ�Ԫ���ᣬ����뷽��ʽΪH2C2O4![]() 2H++C2O
2H++C2O![]()
B������ζ�KMnO4�����к͵ζ�������ʯ����ָʾ��
C���Ҷ����ͨ����ϩ�����ӳɡ�ˮ�⡢�����������Ƶ�
D����ŨH2SO4�μӵ��Ҷ�����ʹ֮��ˮ�ֽ⣬�ֽ������CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ�Ŵ��ж���ἰ����ɫ������������̬���������� CO2 ����Ч���ÿ��Ի�������ЧӦ�������Դ��ȱ���⡣
(1)ij�о����Ŀ�����Ա���������״��� Na��Fe3O4 �� HMCM��22 �ı��棬�� CO2 Ϊ̼Դ������ˮ������ H2 ��ת��Ϊ�߸���ֵ���������������ͼ��
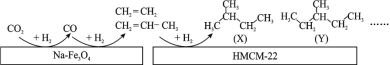
ͼ�� CO2 ת��Ϊ CO �ķ�ӦΪ��CO2(g) + H2(g)=CO(g) + H2O(g) ��H1 = + 41 kJmol-1����֪��2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ��H2=��128 kJmol-1��ͼ�� CO ת��Ϊ C2H4 ���Ȼ�ѧ����ʽ��__________________ ��
(2)�״���δ����Ҫ����ɫ��Դ֮һ���ڹ�ҵ�г��� CO��H2 �ϳɼ״����䷴ӦΪ��CO(g)+2H2(g)CH3OH(g) ��H3 < 0
��Ϊ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬200�� ʱ�� 10 L �����ܱ������н���ʵ�飬��õ�ʵ���������±���ʾ��
ʵ�� | ��ʼŨ��/(mol��L-1) | ��ʼ����/(mol��L-1��min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
�÷�Ӧ���ʵ�ͨʽΪ v��=k�� cm(CO)cn(H2)(k �������¶��йص����ʳ���)���ɱ������ݿ�ȷ����Ӧ����ͨʽ�� m =_______��n =_____(ȡ������)��ʵ�鷢�֣���ʵ�� 1 �� c(H2) = 0.25 molL��1ʱ�ﵽƽ�⣬�����÷�Ӧ��ƽ�ⳣ�� K = _____��
������һ�������� CO �� H2 ��װ�д����ķ�Ӧ���з�Ӧ 12 Сʱ����ϵ�м״��IJ��ʺʹ����Ĵ��������¶ȵĹ�ϵ��ͼ��ʾ��
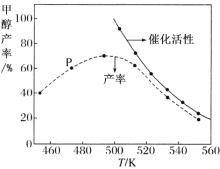
���ж��¶�Ϊ 470 K ʱ��ͼ�� P �� _________(������������������)����ƽ��״̬��490 K ֮�״��������¶����߶���С�Ŀ���ԭ��Ϊ��_____�� _____��
(3)�����������о���Ա�� CO2 ͨ��������ɶ���ȼ�ϣ��乤��ԭ����ͼ��ʾ��
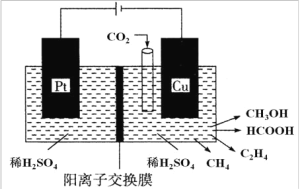
����д�� Cu �缫�ϲ��� CH3OH �ĵ缫��Ӧʽ��_____________��
�����Cu �缫��ֻ���� 0.15 mol C2H4 �� 0.30 mol CH3OH���� Pt �缫�ϲ���O2 �����ʵ���Ϊ ___________mol��
����֪ HCOOH ΪһԪ���ᣬ�����½� 0.1 molL��1 HCOOH ��Һ�� 0.1 molL��1 NaOH ��Һ������� a : b���(������Һ����ı仯)����Ϻ���Һǡ�������ԣ��� HCOOH �ĵ��볣�� Ka=_____________(�ú� a��b �Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com