
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
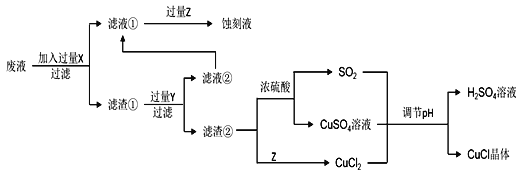
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
【答案】Fe 2Cu2++ 2Cl+SO2+2H2O=2CuCl↓+4H++SO42- 2 Cu2+水解程度增大,反应生成CuCl减少,产率减小; 不能 硝酸会与产品CuCl发生反应 95.5% 2CuOH![]() Cu2O+H2O Kw×Ksp(CuCl)/Ksp(CuOH)
Cu2O+H2O Kw×Ksp(CuCl)/Ksp(CuOH)
【解析】
向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来,则X为Fe、Y为HCl,
故答案为:Fe;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,离子反应方程式:2Cu2++ 2Cl+SO2+2H2O=2CuCl↓+4H++SO42-
故答案为:2Cu2++ 2Cl+SO2+2H2O=2CuCl↓+4H++SO42-;
(3)由表中数据可知,pH=2时,CuCl产率最高;pH较大时,Cu2+水解程度增大,导致反应生成CuCl减少;硝酸具有强氧化性,能将产品CuCl氧化生成Cu2+,所以不能用相同pH的硝酸代替硫酸,
故答案为:2;Cu2+水解程度增大,反应生成CuCl减少,产率减小;不能;硝酸会与产品CuCl发生反应;
(4)根据题目中所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去,则滴定0.25g样品消耗硫酸铈标准溶液的平均体积为:![]() =24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,CuCl的纯度为:
=24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,CuCl的纯度为:![]() ×100%=95.5%,
×100%=95.5%,
故答案为:95.5%.
(5)CuOH热分解的化学方程式为2CuOH![]() Cu2O+H2O;CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),平衡常数K=c(H+)c(Cl-)=
Cu2O+H2O;CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),平衡常数K=c(H+)c(Cl-)= ×
×
![]()
答案为:![]()


科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
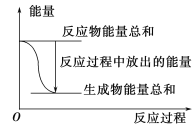
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
(1)实验室需要1mol·L-1NaOH溶液245mL,请回答下列问题:
①为了配制此溶液应选择____mL的容量瓶,用天平称取____g NaOH。
②溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度____(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,洗涤液若不转移入容量瓶,会导致溶液的浓度____。
③当溶质完全转移至容量瓶后,需要确定溶液的容积,我们称之为定容。定容时,先直接加水至刻度下1~2cm处,改用___加水至溶液凹液面与刻度线相切。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.过滤 E.蒸馏 F.分液
①分离饱和食盐水与沙子的混合物____;
②从碘水中提取碘单质____;
③分离水和汽油的混合物___;
④分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Ca2+、AlO2-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶有进行了如下实验下列判断正确的是( )

A.K+、AlO2-、SiO32-和CO32-一定存在于溶液X中
B.沉淀甲是硅酸和硅酸钙的混合物
C.气体甲一定是纯净物
D.SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O
2MgO+C;④Mg+H2O![]() MgO+H2↑;⑤Mg3N2+6H2O
MgO+H2↑;⑤Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。


回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是_____;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?____,原因是____;
(4)请设计一个实验,验证产物是氮化镁:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 与氢气反应的化学方程式是__________;
与氢气反应的化学方程式是__________;
(2)写出正戊烷CH3(CH2)3CH3的两种同分异构体的结构简式和名称(系统命名法):
①结构简式:_____________、名称:_____________
②结构简式:_____________、名称:_____________。
(3)某一氯代烷烃分子中有2个“-CH3”、2个“-CH2-”、1个“ ”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:
”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:![]() 、
、 、_________、_________。
、_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制各水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaC1O溶液。已知:3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________;若装置C中出现堵塞,玻璃管a中的现象为_______________;B中用冰水浴控制温度在30℃以下,其主要目的是______________。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaC1O=N2↑+3H2O+2NaC1)。
(3)分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaC1O混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500 mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:

下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com