
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
分析 A.甲为短周期中原子半径最大的主族元素的单质,则甲为Na,乙为氧气;
B.甲为单质,既能与盐酸反应又能与NaOH溶液反应,则甲为Al;
C.丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则丙为HCl,丁为NH3;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,戊为硫酸,则含S元素的化合价符合题意.
解答 解;A.甲为短周期中原子半径最大的主族元素的单质,则甲为Na,乙为氧气,二者反应生成的丙可能为Na2O2或Na2O,故A错误;
B.甲为单质,既能与盐酸反应又能与NaOH溶液反应,则甲为Al,乙为氧气,二者反应生成丙为氧化铝,属于两性氧化物,故B正确;
C.丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则丙为HCl,丁为NH3,若乙为氯气,其水溶液中含有HClO,具有漂白作用,故C正确;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,丁为HClO等具有强氧化性的物质,戊为硫酸,则含S元素的化合价由低到高的顺序为甲<丙<戊,故D正确;
故选A.
点评 本题考查无机物的推断,熟悉物质的性质及转化关系图中的反应是解答本题的关键,注意选项D为解答的难点,符合甲、丙、戊中同种元素的化合价升高为非金属元素或变价金属元素,题目难度较大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烯与氯化氢加成 | B. | 2-溴丙烷与NaOH醇溶液共热 | ||
| C. | 1-溴丁烷与NaOH醇溶液共热 | D. | 1-溴丙烷与NaOH溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
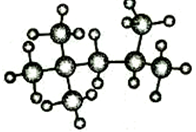 完成下列空白.
完成下列空白.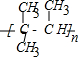 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
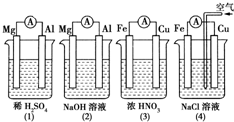
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
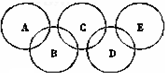 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水呈碱性:NH3•H2O=NH4++OH- | |
| B. | 碳酸氢钠治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 久置的浓硝酸呈黄色:4HNO3=4NO2↑+O2↑+2H2O | |
| D. | 久置碳酸氢铵有刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com