
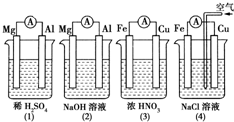
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
分析 A、根据氧化还原反应,失电子的极是负极;
B、原电池的正极发生得电子的还原反应;
C、铜作负极发生氧化反应;
D、铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,失电子的是金属铜,为负极,故A错误;
B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;
C、③中金属铁在常温下遇浓硝酸钝化,失电子的是金属铜为负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu-2e-═Cu2+,故C错误;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误.
故选B.
点评 本题考查学生原电池的工作原理知识,可以根据所学内容来回答,难度不大.


科目:高中化学 来源: 题型:解答题

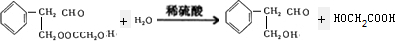
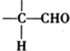 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$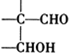 -CHO+
-CHO+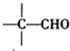 +NaOH(浓)→
+NaOH(浓)→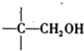 +
+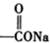
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )| A. | ③④ | B. | ①④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
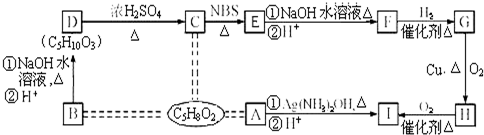
 ③
③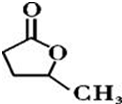 、
、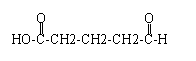 .
.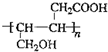 .
.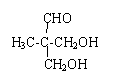 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com