
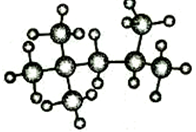
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )| A. | ③④ | B. | ①④ | C. | ②③④ | D. | ①②③④ |
分析 由结构模型可写出该有机物的结构简式为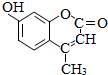 ,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
解答 解:由有机物的价键规则(碳原子形成4条键,氧原子形成2条键,氢原子形成1条键)可知该有机物的结构简式为 ,
,
①由结构简式可知其分子式为C10H8O3,故错误;
②该有机物中含有碳碳双键,故能与溴水和氢气发生加成反应,只有酚-OH的两个邻位与溴水发生取代反应,1mol该物质能与2mol溴水发生取代反应,故错误;
③含碳碳双键,酚-OH、-COOC-三种官能团,故正确;
④含碳碳双键、酚-OH,均能使酸性高锰酸钾溶液褪色,故正确;
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团及性质的关系为解答的关键,熟悉苯酚、烯烃的性质为即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
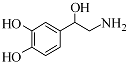
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有2个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
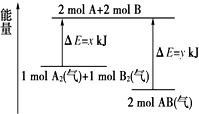
| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 完成下列空白.
完成下列空白.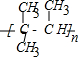 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
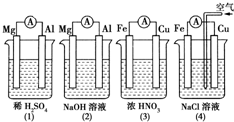
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,OH-向负极移动 | |
| C. | 放电时,电流由钙电极流向硫酸铅电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com