
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش��������⣺
һ���¶��£���һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g��CH3OH��g����H��0
��1���������β���˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.ÿ����1mol CO��ͬʱ����2molH2
B.������������ʵ�������
C.����CH3OH������������CO���������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��B��C�����ƽ�ⳣ��KB��KC�Ĵ�С��ϵΪ �� 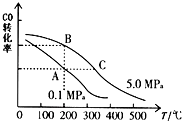
��3��ij�¶��£���2.0mol CO��6.0molH2����2L���ܱ������У��ﵽƽ��ʱ���c��CO��=0.25mol/L��CO��ת����= �� ���¶��µ�ƽ�ⳣ��K=��������λ��Ч���֣���
��4���¶�650���������ȼ�ϵ�أ��ã�CO��H2������Ӧ�������CO2�Ļ������Ϊ������Ӧ������缫����Li2CO3��Na2CO3�����������ʣ��õ�ص�������ӦʽΪ ��
��5����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1��C
��2��KB��KC
��3��75%��1.3
��4��O2+4e��+2CO2=2CO32��
��5��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJ?mol��1
���������⣺��1��A��ÿ����1mol CO��Ч������2molH2��ͬʱ����2molH2 �� ���淴Ӧ������ȣ���A��ȷ�� B��������������ʵ������䣬˵�������ʵ������䣬��Ӧ��ƽ��״̬����B��ȷ�� C������CH3OH������������CO��������ȣ������ֵ�����Ӧ����C���� D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��˵�������ʵ������䣬��Ӧ��ƽ��״̬����D��ȷ����ѡ��C����2����B����A���¶���ͬ��K���䣬����������Ӧ�¶�����ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������A��B��C�����ƽ�ⳣ��KA=KB��KC �� ���Դ��ǣ�KB��KC����3����2.0mol CO��6.0mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.25mol/L����
CO��g��+ | 2H2��g���T | CH3OH��g�� | |
��ʼŨ�ȣ� | 1.0 | 3.0 | 0 |
�仯Ũ�ȣ� | 0.75 | 1.5 | 0.75 |
ƽ��Ũ�ȣ� | 0.25 | 1.5 | 0.75 |
CO��ת���� ![]() ��100%=75%�����¶��µĻ�ѧƽ�ⳣ��K=
��100%=75%�����¶��µĻ�ѧƽ�ⳣ��K= ![]() =
= ![]() ��1.3�����Դ��ǣ�75%��1.3����4�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ���缫��ӦʽΪ��O2+4e��+2CO2=2CO32�� �� ���Դ��ǣ�O2+4e��+2CO2=2CO32������5����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ������H2��g��+
��1.3�����Դ��ǣ�75%��1.3����4�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ���缫��ӦʽΪ��O2+4e��+2CO2=2CO32�� �� ���Դ��ǣ�O2+4e��+2CO2=2CO32������5����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ������H2��g��+ ![]() O2��g��=H2O��l����H=��285.8kJmol��1����CH3OH��l��+
O2��g��=H2O��l����H=��285.8kJmol��1����CH3OH��l��+ ![]() O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1 �� �ɸ�˹���ɿ�֪��3���٩��ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 �� ���Դ��ǣ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 ��
O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1 �� �ɸ�˹���ɿ�֪��3���٩��ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 �� ���Դ��ǣ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 ��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�з�Ӧ�����������У�FeCl2��FeCl3��CuCl2��Cu�� 
��1����������Ӧ��Ƴɵ�ԭ�����ͼ����ʾ����ش��������⣺ ��ͼ��X��Һ������Cu�缫�Ϸ����ĵ缫��ӦʽΪ��
��ԭ��ع���ʱ�������е����ӣ��K+����Cl���������Ͻ���X��Һ�У�
��2����������Ӧ��Ƴɵĵ�����ͼ����ʾ�����ձ��н��������ӵ����ʵ��������ת�Ƶ����ʵ����ı仯��ϵ��ͼ������ش��������⣺ ��M��������ͼ���еĢ��������ӵı仯��
�۵�����ת��Ϊ2molʱ�������ձ��м���L 5molL��1NaOH��Һ����ʹ���еĽ��������ӳ�����ȫ��
��3��������Ҫ������������ƣ�Na2FeO4����һ����������ˮ�����������кܶ��ŵ㣮 �ٸ���������������֮һ�ǵ�ⷨ����ԭ��ΪFe+2NaOH+2H2O ![]() Na2FeO4+3H2��������ʱ�����ĵ缫��Ӧʽ�� ��
Na2FeO4+3H2��������ʱ�����ĵ缫��Ӧʽ�� ��
�ڸ���������������֮������ǿ���Խ�������NaClO����Fe��OH��3���ɸ������ơ��Ȼ��ƺ�ˮ���÷�Ӧ�����ӷ���ʽΪ ��
��Na2FeO4����������ˮ��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�����л������е���Ҫ���ʣ������д��ڵ�˫��������ֵĽṹ��Ϊ����ṹ��������ṹ�Ķ�ϩ����Ϊ����ϩ�������������գ�
��1�����������к��й���ṹ���� �� �����ţ� ![]()
��2�������ϩ���ļӳ�λ���ж��ֿ��ܣ���Ȼ�ĵ������巴Ӧ�IJ���������֣�
��3�������ϩ��������������뺬̼̼˫���������Ļ�������мӳɣ����磺 ![]()
��Ҫ�Ʊ� ![]() ��������ṹ��ԭ�Ͽ�������д�ṹ��ʽ��
��������ṹ��ԭ�Ͽ�������д�ṹ��ʽ��
��4�����һ����1��3������ϩ�ϳ���ȼ�� ![]() �ĺϳ�·�ߣ��������Լ���ѡ����
�ĺϳ�·�ߣ��������Լ���ѡ����
���ϳ�·�߳��õı�ʾ��ʽΪ��A ![]() B��
B�� ![]() Ŀ����� �� ��
Ŀ����� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ��淴ӦX2+3Y22Z2 �ڷ�Ӧ�����еķ�Ӧ����V��ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ���ǣ� �� 
A.t1ʱ��ֻ��������Ӧ
B.t2ʱ����Ӧ������
C.t2��t3 �� ��Ӧ���ٷ���
D.t2��t3 �� �����ʵ�Ũ�Ȳ��ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����������ȷ�Ӧ���ǣ� ��
A.������������Ӧ
B.̼��ƷֽⷴӦ
C.KOH��ϡ���ᷴӦ
D.��˿��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ���л���AΪһ����ɫҺ�壬��A�����ɷ�������һϵ�з�Ӧ�� 
��ش�
��1��E�еĹ����������� ��
��2��A�Ľṹ��ʽΪ ��
��3��д����Ӧ�۵Ļ�ѧ����ʽ�� �� �÷�Ӧ�ķ�Ӧ������ ��
��4��д����Ӧ�ܵĻ�ѧ����ʽ�� ��
��5����������������A��ͬ���칹�����������������칹���֣�д������һ�ֵĽṹ��ʽ�� ��
�ٱ�����������ȡ������ ���ܷ���ˮ�ⷴӦ�� ���ܷ���������Ӧ��
��6��H��E��һ��ͬ���칹�壬��֪H���Ժͽ����Ʒ�Ӧ�ų�����������һ�������¿ɷ���������Ӧ����д��H����������Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ�����н�������ʵ�飺
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | û�����Ա仯����Һ��Ϊ��ɫ | �а�ɫ�������ɣ���ҺΪ��ɫ | ����ɫ����ų� |
���½�����ȷ���ǣ� ��
A.���������Ա仯��˵������Һ����Ӧ
B.���еİ�ɫ����ΪCuCl2
C.���е����ӷ���ʽΪ2H++Zn�TZn2++H2��
D.���з����ķ�Ӧ�������ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ߷���P�ĺϳ�·�����£�
��1��A�ķ���ʽ��C7H8 �� ��ṹ��ʽ�� ��
��2���Լ�a�� ��
��3����Ӧ�۵Ļ�ѧ����ʽ�� ��
��4��E�ķ���ʽ��C6H10O2 �� E�к��еĹ����ţ� ��
��5����Ӧ�ܵķ�Ӧ������ ��
��6����Ӧ�ݵĻ�ѧ����ʽ�� ��
��7����֪��2CH3CHO 
����ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л�����ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14gͭ���Ͻ�������ijŨ�ȵ����ᷴӦ��ʹ�ų���������1.12L����״�����������ǡ�ñ�ˮȫ�������������ᣬ��Ͻ���ͭ������Ϊ�� ��
A.3.2g
B.4.43g
C.10.8g
D.12.4g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com