
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是 ( )
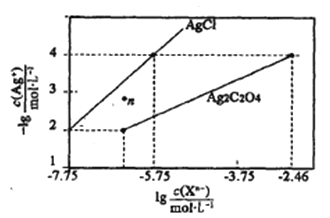
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c (Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4 +2Cl–(aq)2AgCl+C2O42-(aq)的平衡常数为109.04
【答案】D
【解析】
A.Ksp(Ag2C2O4)=c2(Ag+)·c(C2O42-)=(10-4)2×(10-2.46)=10-10.46,Ksp(Ag2C2O4)的数量级为10-11,故A错误;
B.在n点,c(Ag+)大于平衡浓度,故n点的浓度积Qc(AgCl)>Ksp(AgCl),n为氯化银的过饱和溶液,将有沉淀析出,故B错误;
C.由图象可知,c (Cl-)=c(C2O42-),当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
D.Ag2C2O4+2Cl-![]() 2AgCl+C2O42-的平衡常数K=
2AgCl+C2O42-的平衡常数K=![]() ,此时溶液中的c(Ag+)相同,故有:K=
,此时溶液中的c(Ag+)相同,故有:K=![]() =
=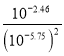 =109.04,故D正确。
=109.04,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】CH4-CO2的催化重整不仅可以得到合成气(CO和H2)。还对温室气体的减排具有重要意义。
CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
C(s)+![]() O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol
该催化重整的热化学反应方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示。下列说法中正确的是
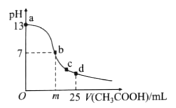
A.在b点的溶液中:m>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.在c点的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在d点的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在a一b的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
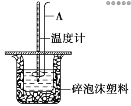
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
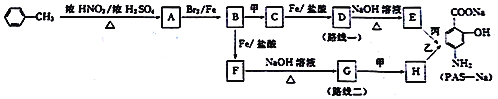
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2O和BF3的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 直线形;平面三角形 D. V形;平面正三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
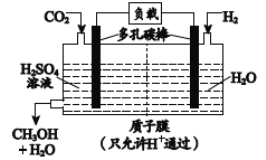
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、D、E、G、J在周期表中的位置如下: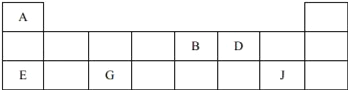
(1)根据上表回答问题:
①D在周期表中的位置是__.
②A、B、E、G的原子半径由大到小的顺序是__(填元素符号).
③B、D的气态氢化物的稳定性关系为__(填化学式).
④34Se与D同主族,其非金属性比D__(填“强”或“弱”),从原子结构的角度解释其原因为__.
⑤E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为ⅰ.H++OH﹣=H2O、ⅱ._________、ⅲ.________.
(2)如图所示转化关系中的各物质由以上六种元素的一种或多种组成,其中甲、乙、丙、丁为两种元素组成的化合物,甲、丙的分子属于10电子微粒,丙为常见溶剂.(图中部分产物已略)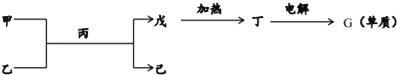
①物质己中含有的化学键的类型为__.
②用电子式表示丙分子的形成过程为__.
③由丁电解制得G单质的化学反应方程式为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。C02是目前大气中含量最高的一种温室气体,C02的综合利用是解决温室及能源问题的有效途径。
(1)研究表明C02和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:CH3OH(g)+![]() O2(g)= CO2(g)+2H2O(g)△H1=akJmol-,H2(g)+
O2(g)= CO2(g)+2H2O(g)△H1=akJmol-,H2(g)+![]() O2(g)=H2O(l)△H2,则CO2(g)+3H2(g)= CH3OH(g)+2H2O(l)△H=___kJmol-。
O2(g)=H2O(l)△H2,则CO2(g)+3H2(g)= CH3OH(g)+2H2O(l)△H=___kJmol-。
(2)C02催化加氢也能合成低碳烯烃:2C02(g)+6H2(g) =C2H4(g)+4H20(g),不同温度下 平衡时的四种气态物质的物质的量如图所示,曲线c表示的物质为____(填化学式)。

(3)C02和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A: C02(g)+3H2(g) = CH30H(g)+H20(g)
反应B: C02(g)+H2(g)=C0(g)+H20(g)
控制C02和H2初始投料比为1 : 3时,温度对C02平衡转化率及甲醇和CO产率的影响如图所示。
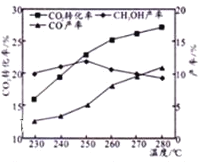
①由图可知温度升高CO的产率上升,其主要原因可能是________。
②由图可知获取CH3OH最适宜的温度是____________。下列措施不能提高C02转化为CH3OH的平衡转化率的有______(填字母)。
A.使用催化剂 B.增大体系压强 C.增大C02和出的初始投料比
(4)在催化剂表面通过施加电压可将溶解在酸性溶液中的二氧化碳直接转化为乙醇,则生成 乙醇的电极反应式为_________。
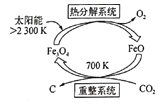
(5)由C02制取C的太阳能工艺如图所示。“热分解系统”发生的反应为 2Fe304 ![]() 6Fe0+02↑。毎分解1mo;Fe304转移电子的物质的量为______;“重整系统”发生反应的化学方程式为_______。
6Fe0+02↑。毎分解1mo;Fe304转移电子的物质的量为______;“重整系统”发生反应的化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com