
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________。
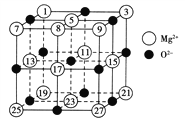
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若ABn分子的中心原子上没有孤对电子,应用价层电子对互斥模型理论,判断下列说法正确的是
A. n=3时,则分子的立体构型为V形
B. n=2时,则分子的立体构型平面三角形
C. n=4时,则分子的立体构型为正四面体形
D. n=4时,则分子的立体构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L 1 mol/L FeCl3溶液与3 L 0.5 mol/L KCl溶液中的Cl-的数目之比
A.1:6B.1:1C.2:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B元素和N元素对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态氮原子的外围电子排布图为________________;晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的__________________性。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,与氨硼烷互为等电子体的分子、离子的化学式分别是______________、________________。 (各举一例),第二周期元素中第一电离能介于B和N之间的元素是______________(填元素符号)。
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如下图:

①己知吡咯中的各个原子均在同一平面内;则吡咯分子中N原子的杂化类型为________________。
②1mol吡咯分子中所含的σ键总数为__________个;分子中的大π键可用Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为____________。
③C、N、O三种元素的简单氢化物键角由小到大的顺序为_____________(填化学式),原因是__________________。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过___________键相结合。
(4)氮化硼(BN)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。已知该晶体密度为ag/cm3,根据硬球接触模型计算晶体中两个最近的N原子间的距离为:_________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有![]() 键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
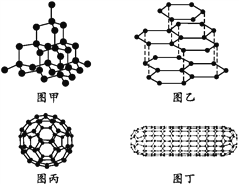
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是____。
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨____(填“活泼”“一样活泼”或“更不活泼”),理由是___。
(3)由图中石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为____。
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有____个碳原子(填数字),每个碳原子上的任两个C—C键的夹角都是____(填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表前四周期的元素,它们的核电荷数:B<A<C<D<E<F。B、C两种元素都能引起水体富营养化。E原子得到一个电子后3p轨道全充满。A+比E原子形成的离子少1个电子层。D可以形成两种氧化物,其中一种氧化物是形成酸雨的主要气体之一。F的原子序数为26。请回答下列问题:
(1)C、D、E的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)写出B的氢化物与水反应的离子方程式:________________,B的氢化物极易溶于水的原因是____________________________________________________________。
(3)化合物BE3的分子空间构型为________________。
(4)F元素原子的核外电子排布式为________。F的一种常见化合物F(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,则F(CO)5的晶体类型为__________________。
(5)将FE3的饱和溶液滴入沸水中,请写出有关反应的离子方程式:___________________________。
(6)比较B、C两种元素的氢化物稳定性并说明理由:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com