
【题目】镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________。
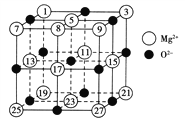
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________。
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________________。
【答案】 增大熔融盐中的离子浓度,从而增强熔融盐的导电性 ⑧应为黑色 NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2的熔点远比SiF4的高,又因为Mg2+的半径小于Na+的半径,且Mg2+的电荷数大于Na+的电荷数,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点高于NaF的熔点
【解析】(1)钠、钾、钙等氯化物在熔融盐中电离,所以其作用除了可变成混合物而降低熔点外,还能够增大熔融盐中的离子浓度,增强导电性;(2)因为氧化镁与氯化钠的晶胞相似,所以在晶体中每个Mg2+周围应该有6个O2-,每个O2-周围应该有6个Mg2+,根据此规则可得⑧应该改为黑色;(3)物质的熔点与其晶体的类型有关,如果形成的是分子晶体,则其熔点较低,而如果形成的是离子晶体,则其熔点较高,在离子晶体中,离子半径越小,电荷数越多,则形成的离子键越强,所得物质的熔、沸点越高。三种物质中,氟化钠和氟化镁是离子晶体,而氟化硅是分子晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应曾用于检测司机是否酒后驾驶:
2Cr2O![]() +3CH3CH2OH+16H++13H2O―→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O―→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是______(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型分别为____________;1 mol CH3COOH分子中含有σ键的数目为__________。
(3)与H2O互为等电子体的一种阳离子为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,国际上提出的“绿色化学”是指化学工业生产中( )。
A.对废水、废气、废渣进行严格处理
B.化学生产中不排放任何有害物质
C.化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,溶液导电性增强的是( )
A.0.50 mol Ba(OH)2B.100 mL水
C.0.50 mol 酒精D.0.50 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.摩尔是国际单位制中的一个基本物理量
C.3.01×1023个SO2分子的质量为32g
D.C2H5OH的摩尔质量为46g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A、B、C、D、E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,B为红棕色。

(1)写出各物质的化学式:A________,B________,C________,D________,E________。
(2)写出各步反应的化学方程式:
①A→C:____________________________________________________________。
②B→E:____________________________________________________________。
③C→B:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com