
【题目】某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,溶液导电性增强的是( )
A.0.50 mol Ba(OH)2B.100 mL水
C.0.50 mol 酒精D.0.50 mol Na2SO4
科目:高中化学 来源: 题型:
【题目】(1)如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是_____

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
(3)①室温下,在0.5mol/L纯碱溶液中加入少量水,由水电离出的c(H+)×c(OH-)_________。(填“变大”、“变小”、“不变”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.00008mol/LK2CrO4溶液,则溶液中的c(CrO42-)=___________。
③室温下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e—=Na2S+Fe,则该电池在充电时,阳极发生反应的物质是____________,放电时负极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:
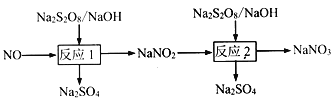
(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
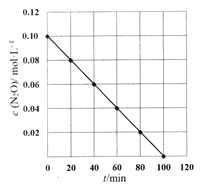
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________。
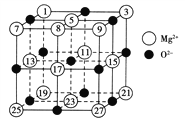
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
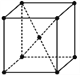
(1) 每一个晶胞中分摊到________个钨原子。
(2) 计算晶胞的边长a_____。
(3) 计算钨的原子半径r_____ (提示:只有体对角线上的各个球才是彼此接触的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列离子能大量共存的是
A.Na+、NH4+ 、NO3-、MnO4-B.K +、 SO42-、Cl-、Mg2+
C.K +、 H+ 、 HCO3-、Br-D.Ba2+ 、Na+ 、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作还原剂的是
A. 2H2O![]() 2H2 ↑+ O2↑ B. 2Na+ 2H2O=2NaOH + H2↑
2H2 ↑+ O2↑ B. 2Na+ 2H2O=2NaOH + H2↑
C. 2F2+ 2H2O = 4HF + O2 D. Na2O + H2O = 2NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有![]() 键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
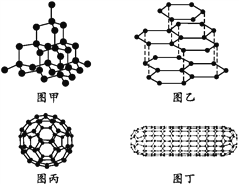
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是____。
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨____(填“活泼”“一样活泼”或“更不活泼”),理由是___。
(3)由图中石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为____。
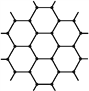
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有____个碳原子(填数字),每个碳原子上的任两个C—C键的夹角都是____(填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com