
【题目】科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有![]() 键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
键,因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图。图中小黑点均代表碳原子。
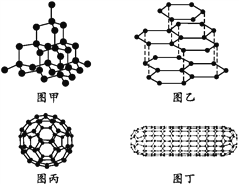
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是____。
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨____(填“活泼”“一样活泼”或“更不活泼”),理由是___。
(3)由图中石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为____。
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有____个碳原子(填数字),每个碳原子上的任两个C—C键的夹角都是____(填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是____。
【答案】 碳原子排列方式不同 活泼 足球烯含有![]() 键容易加成 2∶3 6 109°28'(或109.5°) 碳纳米管
键容易加成 2∶3 6 109°28'(或109.5°) 碳纳米管
【解析】(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,通过四种物质的结构示意图可以得出其原因是碳原子排列方式不同;正确答案:碳原子排列方式不同。
(2) 足球烯的结构中含有![]() ,容易与单质F2发生加成反应,而石墨均为碳碳单键,同条件下,石墨与单质F2发生反应就相应较难;正确答案:活泼;足球烯含有
,容易与单质F2发生加成反应,而石墨均为碳碳单键,同条件下,石墨与单质F2发生反应就相应较难;正确答案:活泼;足球烯含有![]() 键容易加成。
键容易加成。
(3)每个碳原子被三个碳环共有,每个碳环含有碳原子数为1/3;每条碳碳单键被2个碳环共有,每个碳环含有1/2条碳碳单键;因此C原子数与C—C键数之比为1/3:1/2=2:3;正确答案:2∶3。
(4)金刚石是原子晶体,原子间以共价键相结合,形成三维的空间网状结构,最小的环上有6个碳原子;每个碳原子以4个共价键对称的与相邻的4个碳原子结合,碳原子采取sp3杂化方式形成共价键,所以碳原子与其周围的4个碳原子形成正四面体结构,夹角109°28,;正确答案:6; 109°28,(或109.5°) 。
(5) 由于碳纳米管表面积大,可以吸附H2,用作贮氢材料;正确答案:碳纳米管。


科目:高中化学 来源: 题型:
【题目】某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,溶液导电性增强的是( )
A.0.50 mol Ba(OH)2B.100 mL水
C.0.50 mol 酒精D.0.50 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法不正确的是

A. 简单离子半径:Y>Z>X B. 沸点:D
C. 气态氢化物稳定性:Z>Y D. 0.1mol·L-1A溶液中:c(H+)>c(HY-)>c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有________个与之紧邻且等距离的CO2分子。在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为____________________________,反应的化学方程式是__________________。
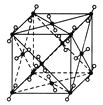
(2)下列三种晶体①CO2,②CS2,③SiO2的熔点由高到低的顺序是________>________>________(用序号填空),其原因是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
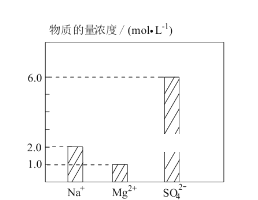
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如下:

回答下列问题:
(1)I中含氧官能团的名称为___________________。
(2)由B生成C的化学方程式为_______________________________。
(3)由E和F反应生成D的反应类型为_______,由G和H反应生成I的反应类型为______。
(4)仅以D为单体合成高分子化合物的化学方程式为_________________ 。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________ 。
(6)参照本题信息,试写出以1-丁烯为原料制取 的合成路线流程图(无机原料任选)__________ 。
的合成路线流程图(无机原料任选)__________ 。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④电镀过程相当于金属的“迁移”,可视为物理变化
A. ③B. ③④C. ②③④D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com