
【题目】最近,国际上提出的“绿色化学”是指化学工业生产中( )。
A.对废水、废气、废渣进行严格处理
B.化学生产中不排放任何有害物质
C.化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)常温下是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3说法中正确的是( )
A. 分子中N—Cl键是非极性键 B. 分子中不存在孤对电子
C. 它的沸点比PCl3沸点低 D. 因N—Cl键键能大,所以NCl3的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解B.有少量NaOH溶液残留在烧杯里
C.向容量瓶中加水未到刻度线D.称量时误用“左码右物”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:
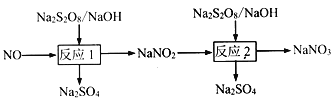
(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
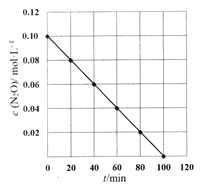
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
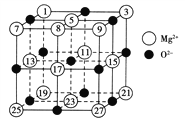
【题目】镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________。
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列离子能大量共存的是
A.Na+、NH4+ 、NO3-、MnO4-B.K +、 SO42-、Cl-、Mg2+
C.K +、 H+ 、 HCO3-、Br-D.Ba2+ 、Na+ 、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L 1 mol/L FeCl3溶液与3 L 0.5 mol/L KCl溶液中的Cl-的数目之比
A.1:6B.1:1C.2:1D.3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com