
【题目】已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
B.已知Ksp(AgBr)<Ksp(AgCl) ,故AgBr不可能转化为AgCl
C.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
【答案】D
【解析】
A. Ksp只与温度有关,与溶液中离子浓度无关。故A错误;
B. 在AgBr饱和溶液中加入足量浓NaCl溶液,当溶液中c(Ag+)×c(Cl-)>1.8×10-10mol2L-2,有AgCl沉淀生成,故B错误;
C. 将AgNO3溶液滴入0.001mol·L-1的KCl中开始产生AgCl沉淀时,需要c(Ag+)=1.8×1010![]() 0.001mol·L-1=1.8×10-7mol·L-1,而AgNO3溶液滴入0.001mol·L-1的K2CrO4溶液开始产生Ag2CrO4沉淀,需要c(Ag+)=
0.001mol·L-1=1.8×10-7mol·L-1,而AgNO3溶液滴入0.001mol·L-1的K2CrO4溶液开始产生Ag2CrO4沉淀,需要c(Ag+)=![]() -=4.36×10-7mol·L-1>1.8×10-7mol·L-1,所以先产生AgCl沉淀,故C错误
-=4.36×10-7mol·L-1>1.8×10-7mol·L-1,所以先产生AgCl沉淀,故C错误
D. 银离子与氨水生成氢氧化二氨合银,使平衡向右移动。故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】钠离子电池开始成为下一轮电池研究的重点,下图是一种可充电钠离子电池(电解质溶液为Na2SO3溶液) 工作时的示意图。下列说法正确的是
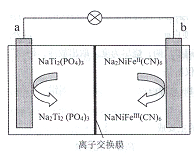
A. 电池放电时,Na+从a极区移动到b极区
B. 电池充电时,b极区发生的反应是:NaNiFeIII(CN)6+ e—+Na+=Na2NiFeII(CN)6
C. 金属钠可以作为该电池的负极材料
D. 若用该电池电解饱和食盐水,理论上每生成1molCl2,电池内有,1molNa+通过间子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )

A.在一定条件下,能发生取代、氧化、酯化和加聚反应
B.该物质分子中最多可以有11个碳原子在同一平面上
C.1 mol该物质完全氧化最多可消耗14mol氧气
D.1 mol该物质最多可与4 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容器中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是( )
A.3∶7∶4B.5∶7∶6C.7∶3∶6D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用![]() 溶液检验
溶液检验
B.苯酚和菠萝酯均可与酸性![]() 溶液发生反应
溶液发生反应
C.苯氧乙酸和菠萝酯均可与![]() 溶液发生反应
溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:通常羟基与碳碳双键相连时不稳定,易发生下列变化:
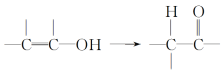
依据如下图所示的转化关系,回答问题:
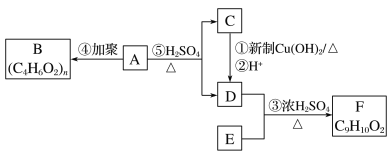
(1)A的化学式是______________________________________________________,官能团是酯基和______________(填名称)。
(2)①的化学方程式是__________________________________________________。
(3)F是芳香族化合物且苯环上只有一个侧链,③的化学方程式是________________________________。
(4)绿色化学中,最理想的“原子经济”是原子利用率100%,上述反应中能体现“原子经济”原则的是______________(填字母)。
a.① b.③ c.④
(5)G是F的同分异构体,有关G的描述:
①能发生水解 ②苯环上有三个取代基 ③苯环上一溴代物有2种
据此推测G的结构简式可能是(写出其中一种)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的是( )
A.  制取乙酸乙酯
制取乙酸乙酯
B.  吸收NH3
吸收NH3
C.  石油的分馏
石油的分馏
D.  比较盐酸、碳酸、苯酚的酸性强弱
比较盐酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol/L的盐酸滴定20.00 mL NaOH溶液,测定其浓度,下列说法正确的是
A.需用NaOH溶液润洗锥形瓶
B.用量筒量取20.00 mL NaOH溶液
C.使用酚酞做指示剂,滴定终点的现象为溶液浅红色褪去,半分钟不变色
D.滴定前,没有除去酸式滴定管中的气泡,滴定后气泡消失,所测浓度会偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com