
【题目】NH4X(X为卤素原子)有关转化过程的能量关系如图所示。下列说法不正确的是

A.ΔH1>ΔH4
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
C.因为NH4Cl固体溶于水吸热,所以ΔH6<0
D.相同条件下,NH4Br的(ΔH2+ΔH3+ΔH5)比NH4I的大
【答案】C
【解析】
A.由NH4X固体分解为三种气体的反应为吸热反应,则ΔH1>0,有X(g)转变为X-(g)是原子结合电子形成稳定结构的过程,能力越低越稳定,则X(g)转变为X-(g)是放热,则ΔH4<0,则ΔH1>ΔH4,故A正确;
B.根据盖斯定律,可知,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=-ΔH6,即ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故B正确;
C.因为由NH4X固体变为NH4+(g)和X-(g)是断开化学键的过程,断键吸收热量,则逆过程形成键需要放热,所以ΔH6<0,不是因为NH4Cl固体溶于水吸热,故C错误;
D.相同条件下,NH4Br和NH4I的ΔH2不同,ΔH3+ΔH5相同,因为Br-Br键的键能大于I-I键的键能,所以使等物质的量的Br2和I2变成原子时,Br2需要吸收的热量多,即NH4Br的ΔH2比NH4I的大,则NH4Br的(ΔH2+ΔH3+ΔH5)比NH4I的大,故D正确;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱进行干燥
2NH3,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
|
|
|
|
A.实验室制取溴苯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室常用的几种气体发生装置如图A、B、C所示。
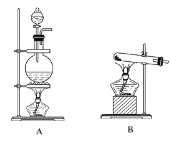
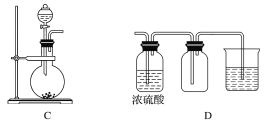
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的试剂是_________;
检查C装置的气密性是否良好的操作方法是____________________________。
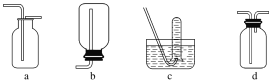
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
如图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
II.镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O(未配平)
(4)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素及其化合物在生产生活中至关重要。
(1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中含有的化学键包括____________________。
(2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。
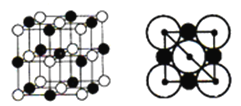
(4)氯化钠的晶胞结构如图所示,图是氯化钠的晶胞截面图(图中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径为____________pm(只需列出计算式)。
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
①请在图中画出砷化硼晶胞的俯视图______。
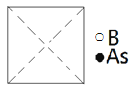
②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法不正确的是
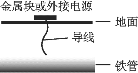
A.钢铁腐蚀时化学能不能全部转化为电能
B.钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C.如图所示,将导线与金属锌相连可保护地下铁管
D.如图所示,将导线与外接电源的正极相连可保护地下铁管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com