
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】A(C2H4O)是基础有机化工原料,由A可制备聚碳酸酯(D)及食用香精茉莉酮(部分反应条件略去)如下图所示:

已知A、B的核磁共振氢谱均只有1组峰
(1)A的名称为 _________ ;G中官能团的名称为 _______ 。
(2)②的反应类型为__________ ;③的反应类型为__________
(3)D的结构简式为 _______ 。
(4)反应①的化学方程式为 _______ 。
(5)G的一种同分异构体,能与FeCl3溶液发生显色反应,苯环上只有2个取代基且互为对位,则符合条件的异构体有 ____ 种,其中核磁共振氢谱只有5组峰的是 ___________(写结构简式)。
(6)依据上述合成路线,试以A和HC≡CLi为原料合成1,3-丁二烯(注明反应条件)_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学反应方程式是高中僧的必备技能,快来闯关吧!
(1)钠加入到三氯化铁溶液中发生的反应(总方程式):_________________________________________________________________
(2)过氧化钠与水的反应:_________________________________________________________________
(3)过氧化钠与二氧化碳的反应:_________________________________________________________________
(4)碳酸氢钠与氢氧化钠的反应: _________________________________________________________________
(5)碳酸氢钠受热分解: _________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在镍催化作用下可与水反应制合成气(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三种元素电负性从小到大的顺序为________。
(2)CH4和CO2分子中碳原子的杂化类型分别是_____和_______。
(3)基态Ni原子的电子排布式为______,该元素位于元素周期表的第_____族。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1molNi(CO)4中含有____molσ键,Ni(CO)4的晶体类型为_____,Ni(CO)4易溶于下列___(填选项字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=_____,储氢后,含1molLa的合金可吸附H2的数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
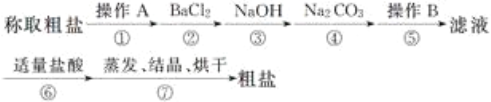
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B. 产物的平均摩尔质量为24g/mol
C. 若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D. 反应中消耗的氧气为56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
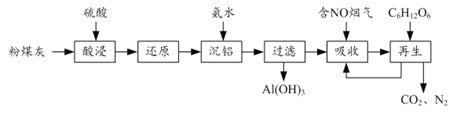
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
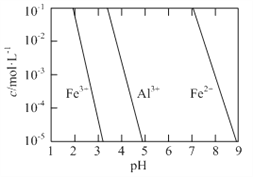
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
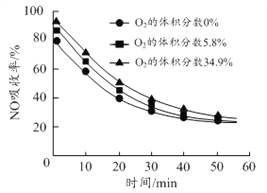
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.做钠的燃烧实验,可将金属钠放在坩埚里
D.向容量瓶转移液体时,导流用玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com