
【题目】下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.做钠的燃烧实验,可将金属钠放在坩埚里
D.向容量瓶转移液体时,导流用玻璃棒
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。
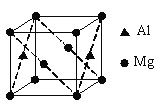
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是
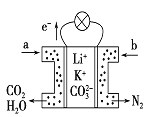
A. 正极电极反应式为O2+2CO2+4e-=2CO32- B. CO32-向正极移动
C. 此电池在常温时也能工作 D. a为CH4,b为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221.0l kJ·mol-1
CO2(g)=C(s)+O2(g) △H=+393.5kJ·mol-1
则①反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_________kJ·mol-1。
②在600K时,将3.0mol NO、3.6mol CO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得N2的浓度为0.2mol·L-1,则NO的转化率![]() =__________,反应平衡常数K=____________(保留两位有效数字)。
=__________,反应平衡常数K=____________(保留两位有效数字)。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是_________(填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:[CoC14]2-+6H2O![]() [Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
[Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
②运用数字化实验探究压强对平衡的影响:
将一收集满干燥NO2的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
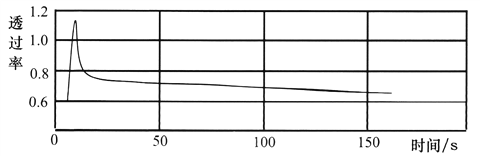
由图可知:增大压强,该混合气体的颜色变化为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com