
【题目】化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221.0l kJ·mol-1
CO2(g)=C(s)+O2(g) △H=+393.5kJ·mol-1
则①反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_________kJ·mol-1。
②在600K时,将3.0mol NO、3.6mol CO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得N2的浓度为0.2mol·L-1,则NO的转化率![]() =__________,反应平衡常数K=____________(保留两位有效数字)。
=__________,反应平衡常数K=____________(保留两位有效数字)。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是_________(填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:[CoC14]2-+6H2O![]() [Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
[Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
②运用数字化实验探究压强对平衡的影响:
将一收集满干燥NO2的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
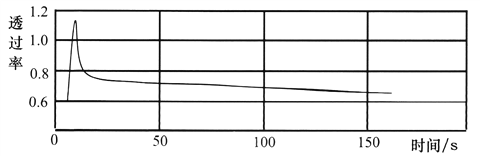
由图可知:增大压强,该混合气体的颜色变化为__________________________。
【答案】 -746.5 40% 0.14 ac 蓝 向右 向溶液加水稀释时,溶液中离子浓度均成比例减少,Qc<K 先变深后变浅,但比原来的颜色深
【解析】试题分析:本题考查盖斯定律的应用、化学平衡的计算、外界条件对化学平衡的影响、实验探究浓度和压强对化学平衡的影响。
(1)①将反应编号,N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1 (①式)
2C(s)+O2(g)=2CO(g) △H=-221.0l kJ·mol-1 (②式)
CO2(g)=C(s)+O2(g) △H=+393.5kJ·mol-1 (③式)
应用盖斯定律,将①式+②式+③式![]() 2得,N2(g)+2CO2(g)=2NO(g)+2CO(g)ΔH=(+180.5kJ/mol)+(-221.01kJ/mol)+(+393.5kJ/mol)
2得,N2(g)+2CO2(g)=2NO(g)+2CO(g)ΔH=(+180.5kJ/mol)+(-221.01kJ/mol)+(+393.5kJ/mol)![]() 2=+746.5kJ/mol,则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=-746.5kJ/mol。
2=+746.5kJ/mol,则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=-746.5kJ/mol。
②用三段式,2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L)1 1.2 0 0
c(转化)(mol/L)0.4 0.4 0.2 0.4
c(平衡)(mol/L)0.6 0.8 0.2 0.4
NO的转化率α=![]() 100%=40%。反应平衡常数K=
100%=40%。反应平衡常数K=![]() =
=![]() =0.14。
=0.14。
③a项,增加CO的量,平衡向正反应方向移动,达到新平衡时NO的体积分数减小;b项,加入催化剂,平衡不移动,达到新平衡时NO的体积分数不变;c项,降低温度,平衡向正反应方向移动,达到新平衡时NO的体积分数减小;d项,扩大容器体积,即减小压强,平衡向逆反应方向移动,达到新平衡时NO的体积分数增大;达新平衡时NO的体积分数一定减小的是ac,答案选ac。
(2)①甲同学向已呈现紫色的氯化钴溶液中通入HCl,HCl电离出Cl-,c(Cl-)增大,平衡向逆反应方向移动,溶液变为蓝色。乙同学向溶液中加水,平衡向右移动,原因是:加水稀释,[CoCl4]2-、[Co(H2O)6]2+、Cl-浓度都成比例减小,此时浓度商Qc![]() K,平衡向右移动。
K,平衡向右移动。
②根据图示,推压活塞,增大压强,该混合气体的颜色先变深后变浅,但最终比原来的颜色深。产生颜色变化的原因是:注射器中存在可逆反应2NO2(g)![]() N2O4(g),推压活塞,容器体积变小,NO2的浓度增大,混合气体的颜色先变深;增大压强,平衡向正反应方向移动,NO2的浓度又减小,混合气体的颜色又变浅;根据勒夏特列原理,平衡向正反应方向移动只能减弱这种改变,最终混合气体的颜色比原来的颜色深。
N2O4(g),推压活塞,容器体积变小,NO2的浓度增大,混合气体的颜色先变深;增大压强,平衡向正反应方向移动,NO2的浓度又减小,混合气体的颜色又变浅;根据勒夏特列原理,平衡向正反应方向移动只能减弱这种改变,最终混合气体的颜色比原来的颜色深。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.做钠的燃烧实验,可将金属钠放在坩埚里
D.向容量瓶转移液体时,导流用玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A. 利用金属钠或者金属钾 B. 利用质谱法
C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据物质的分类标准可将一种物质归属多个类别。现有下列物质:
①![]() ②CH2=CH2 ③
②CH2=CH2 ③![]() ④CH3CH2CH2CH3
④CH3CH2CH2CH3
⑤![]() ⑥
⑥![]() ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]()
(1)⑥中的官能团名称为___________;⑦中的官能团名称为_____________。
(2)属于烯烃的有__________(填序号,下同)。
(3)属于同分异构体的有____________________。
(4)属于芳香烃的有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
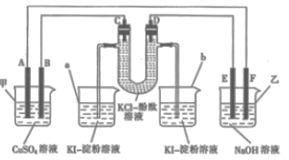
(1)甲池是________(填“原电池”或“电解池”,下同)装置;乙池是________装置。
(2)C极为________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_________________(填“a”或“b”)。
(4)C极上的电极反应式为___________________________________。
(5)甲池中反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,22.4L 氦气与 1mol氢气所含原子数均为 2NA
B. 25 ℃、1.01×105Pa时,2.24 L Cl2中含有的原子数为0.2×6.02×1023
C. 常温常压下,S2和S8的混合物共6.4 g,所含硫原子数一定为0.2 NA
D. 将100 mL 0.1 molL﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com