
【题目】依据物质的分类标准可将一种物质归属多个类别。现有下列物质:
①![]() ②CH2=CH2 ③
②CH2=CH2 ③![]() ④CH3CH2CH2CH3
④CH3CH2CH2CH3
⑤![]() ⑥
⑥![]() ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]()
(1)⑥中的官能团名称为___________;⑦中的官能团名称为_____________。
(2)属于烯烃的有__________(填序号,下同)。
(3)属于同分异构体的有____________________。
(4)属于芳香烃的有_________________________________。
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是
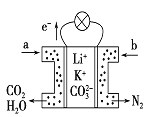
A. 正极电极反应式为O2+2CO2+4e-=2CO32- B. CO32-向正极移动
C. 此电池在常温时也能工作 D. a为CH4,b为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法不正确的是
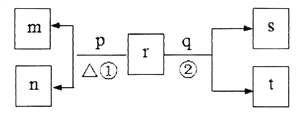
A. 原子半径的大小关系:甲>乙>丙>丁
B. 反应②的离子方程式为:C12+H2O![]() H++C1-+HC1O
H++C1-+HC1O
C. m、n的阴离子在酸性条件下不能大量共存
D. 甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是
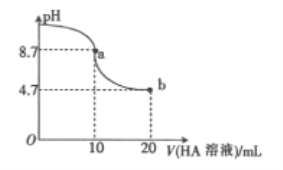
A. a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a点所示溶液中:c(Na+)=0.05mol/L
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中:c(Na+)<c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221.0l kJ·mol-1
CO2(g)=C(s)+O2(g) △H=+393.5kJ·mol-1
则①反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_________kJ·mol-1。
②在600K时,将3.0mol NO、3.6mol CO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得N2的浓度为0.2mol·L-1,则NO的转化率![]() =__________,反应平衡常数K=____________(保留两位有效数字)。
=__________,反应平衡常数K=____________(保留两位有效数字)。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是_________(填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:[CoC14]2-+6H2O![]() [Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
[Co(H2O)6]2++4C1-。甲同学向某已呈现紫色的氯化钴溶液中通入HC1,发现溶液变为________色;乙同学向溶液中加水,平衡移动方向为_______(填“向右”、“向左”或“不移动”),说明原因__________________________________。
②运用数字化实验探究压强对平衡的影响:
将一收集满干燥NO2的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
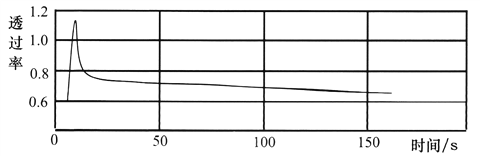
由图可知:增大压强,该混合气体的颜色变化为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
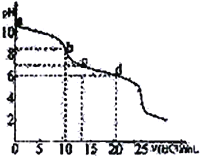
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于某物质是否为电解质的判断正确的是( )
A.固体氯化钠不导电,所以氯化钠不是电解质
B.氯化氢水溶液能导电,所以氯化氢是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.氨水能导电,所以氨水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
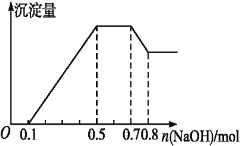
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com