
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
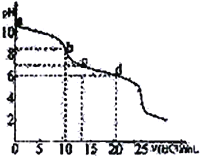
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
【答案】B
【解析】A. a点溶液0.050mol·L-1 Na2CO3和0.025 mol·L-1 NaHCO3混合溶液,Na2CO3和NaHCO3均能水解使溶液呈碱性,但主要原因是CO32-的水解,故A正确。B. b点加入10mL HCl溶液后,溶液中的溶质为NaHCO3和NaCl,故B错误。C.据电荷守恒可知: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+ c(OH-),由于c点溶液显中性,c(H+)= c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故C正确。D. d点加入20mL 0.10mol·L-1HCl溶液后,溶液中c(NaCl)=0.050 mol·L-1,c(NaHCO3)=0.0125mol·L-1,所以c(Na+)>c(Cl-)>c(HCO3-),又因为d点pH<7,所以c(H+)>c(OH-),故D正确。故选B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
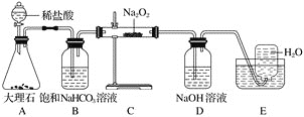
(1)A装置为CO2的发生装置,反应的离子方程式为____________________。
(2)B装置可除去A装置中可能挥发出的___________,反应的离子方程式为_______________。
(3)C装置为O2的发生装置,反应的化学方程式为__________________、________________。
(4)D装置可除去C装置中未反应的__________,反应的离子方程式为____________________。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____________________。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量___溶液,若有白色沉淀生成,则证明固体中含有___;过滤,向滤液中滴入几滴酚酞溶液,若__且不褪色,则证明固体中含有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据物质的分类标准可将一种物质归属多个类别。现有下列物质:
①![]() ②CH2=CH2 ③
②CH2=CH2 ③![]() ④CH3CH2CH2CH3
④CH3CH2CH2CH3
⑤![]() ⑥
⑥![]() ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]()
(1)⑥中的官能团名称为___________;⑦中的官能团名称为_____________。
(2)属于烯烃的有__________(填序号,下同)。
(3)属于同分异构体的有____________________。
(4)属于芳香烃的有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
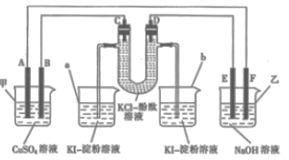
(1)甲池是________(填“原电池”或“电解池”,下同)装置;乙池是________装置。
(2)C极为________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_________________(填“a”或“b”)。
(4)C极上的电极反应式为___________________________________。
(5)甲池中反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,22.4L 氦气与 1mol氢气所含原子数均为 2NA
B. 25 ℃、1.01×105Pa时,2.24 L Cl2中含有的原子数为0.2×6.02×1023
C. 常温常压下,S2和S8的混合物共6.4 g,所含硫原子数一定为0.2 NA
D. 将100 mL 0.1 molL﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如下图所示:
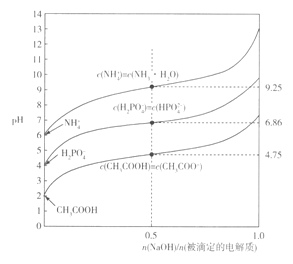
下列说法正确的是
A. NH3·H2O===NH4++OH-的lg K =-9.25
B. 0.1mol/LKH2PO4溶液中:c( HPO42- )<c(H3PO4)
C. CH3COOH+HPO42-=CH3COO-+H2PO4-的lg K = -11.61
D. 在滴定过程中,当溶液pH相同时,消耗NaOH 的物质的量:CH3COOH>KH2PO4> NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
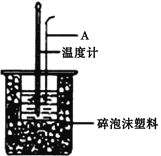
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com