
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
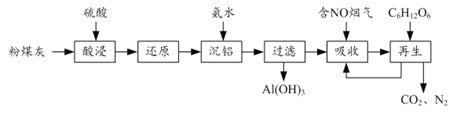
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
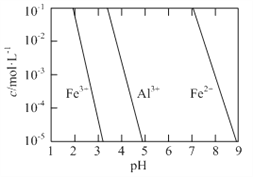
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
【答案】 Al2O3+6H+=2Al3++3H2O 生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解 Fe3+完全沉淀与Al3+开始沉淀的pH相近 增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间 C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
【解析】(1)①“酸浸”时,粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中的Al2O3、Fe2O3、CaCO3被硫酸溶解,其中Al2O3发生反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
②硫酸钙微溶于水。当硫酸质量分数大于50%,生成的硫酸钙覆盖在固体反应物表面,阻止铁、铝氧化物的溶解,使得金属氧化物浸出率明显下降,故答案为:生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解;
(2)根据金属离子以氢氧化物沉淀时离子浓度随pH变化图像,Fe3+完全沉淀与Al3+开始沉淀的pH相近,导致浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差,故答案为:Fe3+完全沉淀与Al3+开始沉淀的pH相近;
(3)①FeSO4溶液吸收NO的原理为Fe2++2NO![]() [Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
[Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应生成二氧化碳和氮气,反应的离子方程式为C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+
6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O;
6Fe2++ 6N2↑+ 6CO2↑+6H2O;
(4)①根据电解目的,要将粗铝通过电解得到高纯铝,需要将粗铝作阳极,高纯铝作阴极,该装置工作时,电极A作阴极,故答案为:阴;
②熔融粗铝时加入铜可以增大阳极熔融物的密度,使之在最下层,故答案为:增大阳极熔融物的密度。


科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2分子中的中心原子杂化轨道类型是______,该分子构型为______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为______。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO______NiO(填“>”、“<”或“=”),理由是______。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:

(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)![]() CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
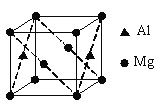
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com