
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2分子中的中心原子杂化轨道类型是______,该分子构型为______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为______。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO______NiO(填“>”、“<”或“=”),理由是______。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)

【答案】 9 Cl>P>S sp3 V形 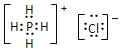 1:1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2)
1:1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2) ![]()
【解析】(1)基态Cl原子的电子排布式是1S22S22P63S23P5,S能级有1个原子轨道,P能级有3个原子轨道,所以共占据9个原子轨道;同周期元素第一电离能从左到右有增大的趋势,第一电离能排序时,P元素电子排布有半充满结构,第一电离能较高,高于S元素而低于Cl元素,所以P、S、Cl的第一电离能由大到小顺序为Cl>P>S。答案为:9、 Cl>P>S
(2)SCl2中S原子杂化轨道数为![]() (6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形,答案为:sp3;V形;
(6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形,答案为:sp3;V形;
(3)PH4+结构类似于NH4+,PH4Cl是离子化合物,据此写出其电子式![]() ;
;
每个CO分子内含有1个σ键和2个π键,而每个CO分子同时又通过1个σ配位键与Ni原子连接,所以σ键和π键之比为1:1。答案为:![]() 、 1:1
、 1:1
(4)晶体结构相同时,离子半径越小离子键强度越高,Mg2+半径比Ni2+小,MgO的晶格能比NiO大,熔点MgO >NiO。答案为:>、Mg2+半径比Ni2+小,MgO的晶格能比NiO大
(5)题中已经给出了坐标系的三个方向示意图,晶胞是边长为1的正方体,因此C点坐标是(1,![]() ,
,![]() )。答案为:(1,1/2,1/2)
)。答案为:(1,1/2,1/2)
(6)图中的单分子层可以如图画出一维重复单元:
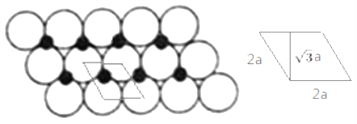
重复单元呈平行四边形,是相邻四个O原子球中心的连线,每个重复单元包含1个O原子和1个Ni原子,NiO相对分子质量为75。重复单元所占的平行四边形面积:![]() ,则1平方米上该晶体质量为:
,则1平方米上该晶体质量为: ![]() 。答案为:
。答案为:![]()


科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸
C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4O)是基础有机化工原料,由A可制备聚碳酸酯(D)及食用香精茉莉酮(部分反应条件略去)如下图所示:

已知A、B的核磁共振氢谱均只有1组峰
(1)A的名称为 _________ ;G中官能团的名称为 _______ 。
(2)②的反应类型为__________ ;③的反应类型为__________
(3)D的结构简式为 _______ 。
(4)反应①的化学方程式为 _______ 。
(5)G的一种同分异构体,能与FeCl3溶液发生显色反应,苯环上只有2个取代基且互为对位,则符合条件的异构体有 ____ 种,其中核磁共振氢谱只有5组峰的是 ___________(写结构简式)。
(6)依据上述合成路线,试以A和HC≡CLi为原料合成1,3-丁二烯(注明反应条件)_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式:________________________________________________________________________。
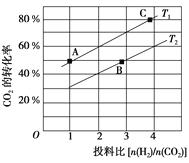
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______________________________;KA、KB、KC三者之间的大小关系为______________________________。
(3)若2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
A.CO和H2的物质的量浓度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
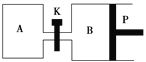
(4)如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数为K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离平衡常数为K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________(填“酸性”“中性”或“碱性”);请计算反应NH+HCO+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
(6)工业上采用电化学还原CO2是一种使CO2资源化利用的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应),下列说法正确的是____________。
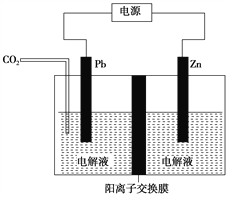
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应式为2CO2+Zn![]() ZnC2O4
ZnC2O4
D.通入11.2 L CO2,转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学反应方程式是高中僧的必备技能,快来闯关吧!
(1)钠加入到三氯化铁溶液中发生的反应(总方程式):_________________________________________________________________
(2)过氧化钠与水的反应:_________________________________________________________________
(3)过氧化钠与二氧化碳的反应:_________________________________________________________________
(4)碳酸氢钠与氢氧化钠的反应: _________________________________________________________________
(5)碳酸氢钠受热分解: _________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在镍催化作用下可与水反应制合成气(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三种元素电负性从小到大的顺序为________。
(2)CH4和CO2分子中碳原子的杂化类型分别是_____和_______。
(3)基态Ni原子的电子排布式为______,该元素位于元素周期表的第_____族。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1molNi(CO)4中含有____molσ键,Ni(CO)4的晶体类型为_____,Ni(CO)4易溶于下列___(填选项字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=_____,储氢后,含1molLa的合金可吸附H2的数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
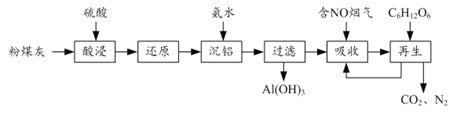
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
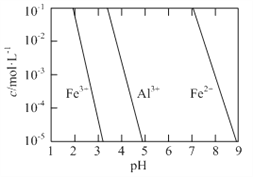
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
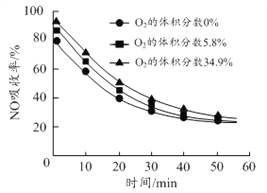
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com