
【题目】化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)![]() CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
【答案】 减小 B < Al3++3H2O![]() Al(OH)3(胶体)+3H+ pH=6
Al(OH)3(胶体)+3H+ pH=6
【解析】(1)由图2分析可知,温度升高,甲醇的物质的量降低,说明平衡逆向移动,由此反应K的表示式可知,升高温度, K值减小。(2)pH=2的盐酸和醋酸溶液分别与适量的Zn粒反应,pH由2变化4所需要时间短的是盐酸,起始时两种的氢离子浓度相同,但醋酸分子不断电离出氢离子,所以,B线代表的是醋酸,因两酸的体积相同,醋酸的浓度大于盐酸,所以消耗的锌的质量也多,即m2> m1。(3)明矾在水中电离产生铝离子,铝离子水解产生具有吸附能力的氢氧化铝胶体,其原理是Al3++3H2O![]() Al(OH)3(胶体)+3H+;(4)Ksp[Cr(OH)3]=c(Cr3+)×c3(OH—)= 6.0×10-7mol/L× c3(OH—) =6.0×10-31,c(OH—)= 1.0×10-8mol/L,pH=6。
Al(OH)3(胶体)+3H+;(4)Ksp[Cr(OH)3]=c(Cr3+)×c3(OH—)= 6.0×10-7mol/L× c3(OH—) =6.0×10-31,c(OH—)= 1.0×10-8mol/L,pH=6。


科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
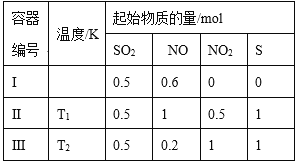
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
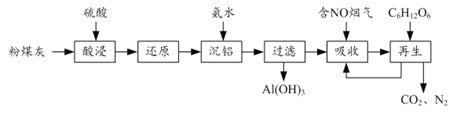
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
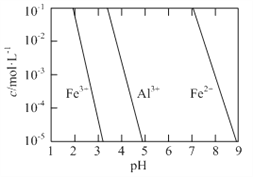
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
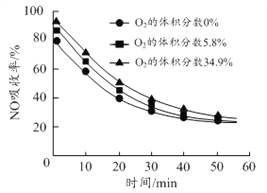
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述不正确的是( )
A. 氧化性:ClO->I2>SO42—
B. 蓝色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2使淀粉变蓝
D. 若将Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:
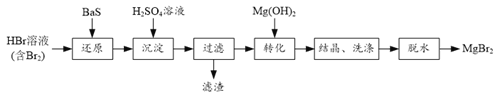
(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。
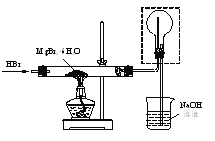
①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转化的认识不正确的是( )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程,在能量转化上比在体外发生的一些能量转化更为合理有效
D.燃料燃烧,只是将化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就可以鉴别乙醇、乙酸溶液、葡萄糖溶液,这种试剂是
A. NaOH溶液 B. Na2CO3溶液
C. 石蕊试液 D. Cu(OH)2悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com