
【题目】下列有关能量转化的认识不正确的是( )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程,在能量转化上比在体外发生的一些能量转化更为合理有效
D.燃料燃烧,只是将化学能转化为热能
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)![]() CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
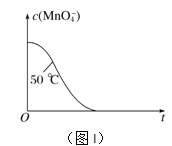
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
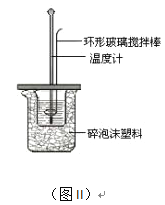
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图甲是实验室常用的一种仪器,其名称是________;其主要用途是________;
(2)小明用某规格的量筒量取一定体积的液体,液面位置如图乙,则其量得液体体积为___或__(用a、b来表示)。
(3)图丙表示10 mL量筒中液面的位置,A与B、B与C刻度相差1 mL,如果刻度A为5,量筒中液体体积是________mL。
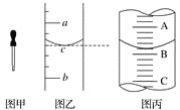
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是
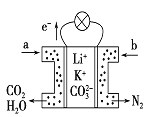
A. 正极电极反应式为O2+2CO2+4e-=2CO32- B. CO32-向正极移动
C. 此电池在常温时也能工作 D. a为CH4,b为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是
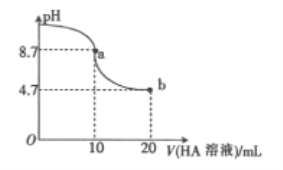
A. a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a点所示溶液中:c(Na+)=0.05mol/L
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中:c(Na+)<c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com