
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:
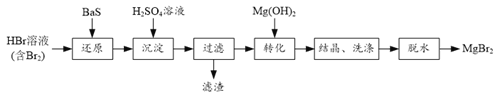
(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。
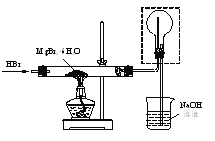
①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
【答案】 后续反应会使用更多的H2SO4、实验过程中会产生有毒的H2S气体 S、BaSO4 蒸馏 带走水蒸气,抑制MgBr2的水解 防止倒吸 将滤液加热煮沸,向冷却后的溶液中缓慢通入SO2气体至反应液的pH约为7(用pH计测得),过滤,用溶有SO2的水洗涤滤渣,在真空干燥箱中干燥
【解析】(1) “还原”步骤中BaS与溴反应生成硫酸钡沉淀或硫沉淀,过量的BaS会与氢溴酸和硫酸反应放出硫化氢气体,因此BaS不宜过量太多,故答案为:后续反应会使用更多的H2SO4、实验过程中会产生有毒的H2S气体;
(2)根据(1)的分析,沉淀中含有硫酸钡沉淀或硫沉淀和过量的BaS,加入硫酸,将沉淀中的BaS溶解,得到的滤渣中主要含有S、BaSO4,故答案为:S、BaSO4;
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,乙醇的沸点降低,可以通过蒸馏的方法从洗涤液中回收乙醇,故答案为:蒸馏;
(4)①MgBr2水解会放出溴化氢气体,通入HBr,可以带走水蒸气,抑制MgBr2的水解,故答案为:带走水蒸气,抑制MgBr2的水解;
②图中框内装置是安全瓶,可以防止倒吸,故答案为:防止倒吸;
(5)由BaS制取高纯BaSO3。取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,BaS+H2O2=Ba(OH)2+S↓,过滤除去硫,得到氢氧化钡溶液,其中含有少量过量的过氧化氢溶液,加热,使过氧化氢分解,然后在氢氧化钡溶液中通入二氧化硫气体,恰好完全反应后溶液中含有水,pH=7,过滤出BaSO3沉淀,用溶有SO2的水洗涤,在隔绝空气的环境中干燥即可,故答案为:将滤液加热煮沸,向冷却后的溶液中缓慢通入SO2气体至反应液的pH约为7(用pH计测得),过滤,用溶有SO2的水洗涤滤渣,在真空干燥箱中干燥。


科目:高中化学 来源: 题型:
【题目】将 4.6g 金属钠投入一定量的水中,待反应完毕后,得到 100mL 溶液.求:
(1)标准状况下产生氢气多少 mL_______________?
(2)所得溶液的物质的浓度是多少_____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:

(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)![]() CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。
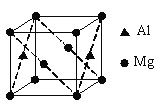
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
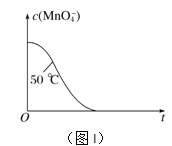
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
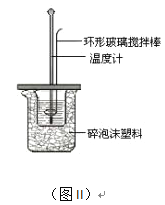
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是
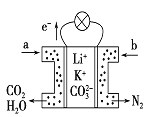
A. 正极电极反应式为O2+2CO2+4e-=2CO32- B. CO32-向正极移动
C. 此电池在常温时也能工作 D. a为CH4,b为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法不正确的是
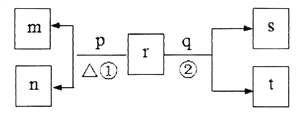
A. 原子半径的大小关系:甲>乙>丙>丁
B. 反应②的离子方程式为:C12+H2O![]() H++C1-+HC1O
H++C1-+HC1O
C. m、n的阴离子在酸性条件下不能大量共存
D. 甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com