
【题目】将 4.6g 金属钠投入一定量的水中,待反应完毕后,得到 100mL 溶液.求:
(1)标准状况下产生氢气多少 mL_______________?
(2)所得溶液的物质的浓度是多少_____________?
【答案】2.24L 2mol/L
【解析】
根据n=![]() 计算4.6gNa的物质的量,根据2Na+2H2O=2NaOH+H2↑,计算生成氢气、NaOH的物质的量,根据V=nVm计算氢气的体积;根据c=
计算4.6gNa的物质的量,根据2Na+2H2O=2NaOH+H2↑,计算生成氢气、NaOH的物质的量,根据V=nVm计算氢气的体积;根据c=![]() 计算所得溶液物质的量浓度。
计算所得溶液物质的量浓度。
解:4.6gNa的物质的量=![]() =0.2mol,
=0.2mol,
2Na+2H2O=2NaOH+H2↑
2 2 1
0.2mol n(NaOH) n(H2)
n(NaOH)=![]() =0.2mol
=0.2mol
n(H2)=![]() =0.1mol
=0.1mol
(1)标况下生成氢气的体积=0.1mol![]() 22.4L/mol=2.24L,
22.4L/mol=2.24L,
答:标况下生成氢气的体积为2.24L;
(2)所得溶液的物质的量浓度![]() =2mol/L,
=2mol/L,
答:所得溶液的物质的量浓度为2mol/L。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. AlN中氮的化合价为+3
C. 上述反应中,每生成1 molAlN需转移3 mol电子
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学反应方程式是高中僧的必备技能,快来闯关吧!
(1)钠加入到三氯化铁溶液中发生的反应(总方程式):_________________________________________________________________
(2)过氧化钠与水的反应:_________________________________________________________________
(3)过氧化钠与二氧化碳的反应:_________________________________________________________________
(4)碳酸氢钠与氢氧化钠的反应: _________________________________________________________________
(5)碳酸氢钠受热分解: _________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在镍催化作用下可与水反应制合成气(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三种元素电负性从小到大的顺序为________。
(2)CH4和CO2分子中碳原子的杂化类型分别是_____和_______。
(3)基态Ni原子的电子排布式为______,该元素位于元素周期表的第_____族。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1molNi(CO)4中含有____molσ键,Ni(CO)4的晶体类型为_____,Ni(CO)4易溶于下列___(填选项字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=_____,储氢后,含1molLa的合金可吸附H2的数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:
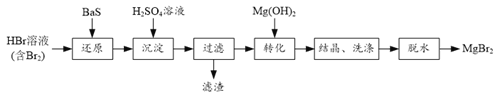
(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。
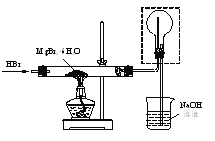
①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com