
【题目】下列反应的产物一定是纯净物的是
A. 丙烯加聚 B. 丙烯与Br2加成
C. 丙烯与水加成 D. 丙烷与Cl2光照取代
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 零族元素与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布
C. 同周期的X、Y元素,且电负性X>Y,则第一电离能也是X>Y
D. 基态原子p能级上半充满的元素一定位于p区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。
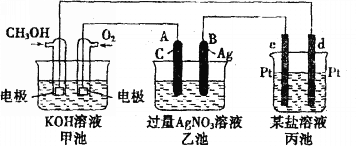
(1)甲池是_________池,通入CH3OH(甲醇)的电极作为_______极,电极反应式为________________________________________________。
(2)乙池是________池,A电极名称为______极,电极反应式为_______________________,乙池中的总反应化学方程式为________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______g;此时丙装置中_____________(填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4.6g 金属钠投入一定量的水中,待反应完毕后,得到 100mL 溶液.求:
(1)标准状况下产生氢气多少 mL_______________?
(2)所得溶液的物质的浓度是多少_____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
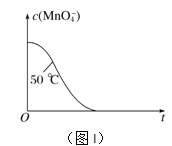
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
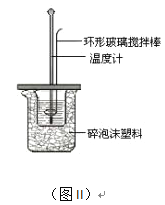
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com