
����Ŀ����A��B��C��D ���ֻ�����ֱ���K+ ��Ba2+ ��SO42 ��CO32��OH�е�������ɣ����Ǿ����������ʣ���A������ˮ�������B������ˮ�����������ᣬ���ų���ɫ�̼�����ζ������E����C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A����D������ˮ������������ʱ�ų�����E��E��ʹ����ʯ��ˮ����ǡ�
��1���ƶ�A��B��C��D�Ļ�ѧʽ��
A____________��B____________��C_____________��D____________��
��2��д�����з�Ӧ�����ӷ���ʽ��
C�����ᷴӦ___________________________________________________
B�����ᷴӦ_______________________________________________________
������E�����ʯ��ˮ��Ӧ___________________________________________
���𰸡�BaSO4 BaCO3 Ba(OH)2 K2CO3 OH����H+ �� H2O BaCO3 + 2 H+ = Ba2+ + H2O + CO2 CO2 + OH�� = HCO3��
��������
![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����ɵĻ������У�
����ɵĻ������У�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��������ˮ�Ļ����
��������ˮ�Ļ����![]() ��
��![]() ��������ˮ�Ҳ�������Ļ����
��������ˮ�Ҳ�������Ļ����![]() ��������ˮ���������ҷų���ɫ��ζ��E��
��������ˮ���������ҷų���ɫ��ζ��E��![]() ���ܹ������ᡢ����ų���ɫ��ζ����Ļ���������ǣ�
���ܹ������ᡢ����ų���ɫ��ζ����Ļ���������ǣ�![]() ��
��![]() ��ˮ��Һ�ʼ��Եģ�
��ˮ��Һ�ʼ��Եģ�![]() ��
��![]() ��
��![]() ��E��ʹ����ʯ��ˮ����ǣ�E��
��E��ʹ����ʯ��ˮ����ǣ�E��![]() ��
��
��1��A�Ȳ�����ˮ�ֲ������ᣬAΪ![]() ��B������ˮ�����������ᣬBΪ
��B������ˮ�����������ᣬBΪ![]() ��C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A��CΪ
��C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A��CΪ![]() ��EΪ��ɫ�̼�����ζ�ҿ�ʹ����ʯ��ˮ����ǵ����壬EΪ
��EΪ��ɫ�̼�����ζ�ҿ�ʹ����ʯ��ˮ����ǵ����壬EΪ![]() ��D������ˮ������������ʱ�ų�����E��DΪ
��D������ˮ������������ʱ�ų�����E��DΪ![]()
��2��CΪ![]() �������ᷴӦ�Ļ�ѧ��Ӧ����ʽΪ��
�������ᷴӦ�Ļ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]() ��BΪ
��BΪ![]() �������ᷴӦ�ĵĻ�ѧ��Ӧ����ʽΪ��
�������ᷴӦ�ĵĻ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]() ��EΪ
��EΪ![]() ��������
��������![]() �����ʯ��ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ��
�����ʯ��ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ��![]() �������ӷ�Ӧ����ʽΪ��
�������ӷ�Ӧ����ʽΪ��![]()


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������Ⱦ��������ǻ�����һ����Ҫ����������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1����֪��N2��g��+O2��g��=2NO��g�� ��H=+180.5kJmol��1
2C��s��+O2��g��=2CO��g�� ��H=��221.0kJmol��1
C��s��+O2��g��=CO2��g�� ��H=��393. 5kJmol��1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g)��H=_____ kJmol��1������
�÷�Ӧ�Է����е�������_______��ѡ������������������������

��2����0.20mol NO��0.10molCO����һ���ݻ��㶨Ϊ1L���ܱ������з�����Ӧ��
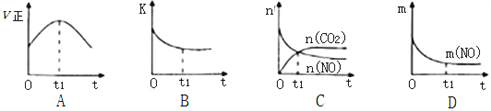
2NO��g��+2CO��g��N2��g��+2CO2��g������Ӧ������ �������ʵ�Ũ�ȱ仯��ͼ��ʾ��
��Ӧ�ӿ�ʼ��9minʱ����CO2��ʾ�÷�Ӧ��������____________________������2λ��Ч���֣�
�ڵ�12minʱ�ı��������______________���������»���������
�۵�18minʱ�����µ�ƽ�⣬���¶��µ�ƽ�ⳣ��Ϊ______________���м���ʽ������24minʱ���������¶Ȳ��䣬���������г���CO��N2��0.060mol��ƽ�⽫_____�ƶ��������������������
��3�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴ﵽƽ��״̬����________________������ţ���
����ͼ��v����K��n��m�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�����������
��4����Ϊȼ�Ͽ���������찱ȼ�ϵ�أ���������Ⱦ�����缫���Ͼ�Ϊ���Ե缫��KOH��Һ���������Һ����õ�ظ����缫��ӦʽΪ______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������ˮ�еμ�NaOH��Һ����Һ��ˮ�����![]() ��NaOH��Һ���֮��Ĺ�ϵ����ͼ��ʾ�������ƶ���ȷ���ǣ� ��
��NaOH��Һ���֮��Ĺ�ϵ����ͼ��ʾ�������ƶ���ȷ���ǣ� ��
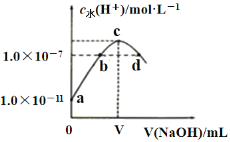
A. ��pH��ֽ�ⶨa���Ӧ��Һ����![]()
B. b��d���Ӧ����Һ�ж����ڣ�![]()
C. c���Ӧ����Һ�У�![]()
D. �����¼�ˮϡ��d���Ӧ����Һ����Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��![]() ��Һ����
��Һ����![]() ��
��![]() ���ֽ�������
���ֽ�������![]() ������
������![]() ���Ũ�ȵĶ���ֵ
���Ũ�ȵĶ���ֵ![]() ��
��![]() �Ĺ�ϵ����ͼ������˵���д�����ǣ� ��
�Ĺ�ϵ����ͼ������˵���д�����ǣ� ��
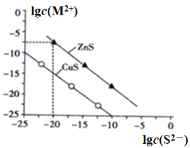
A. ![]() ʱ��
ʱ��![]() ��
��![]() ��
��![]() С
С
B. ![]() ʱ��
ʱ��![]() ԼΪ
ԼΪ![]()
C. ![]() ��Һ�У�
��Һ�У�![]()
D. ��![]() Ũ��Ϊ
Ũ��Ϊ![]() �ķ�ˮ�м���
�ķ�ˮ�м���![]() ��ĩ������
��ĩ������![]() ��������
��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ұ���������ȡ����ϩ�ķ�Ӧ���£�
![]() ��g��
��g��![]() ��g����H2��g��
��g����H2��g��
�ֽ�x mol�ұ�����ͨ������ɱ���ܱ������з�Ӧ��ά����ϵ��ѹǿp���㶨����ij���������£��ұ���ƽ��ת�������¶ȱ仯��ͼ��ʾ��

��֪�������ѹ��p������ ������ѹ��p��������������������Ǹ���Ӧ������˵����ȷ����
A��400��ʱ������ϵ��ͨ��ˮ������v��������v������ ����С�����ұ�ת���ʽ���
B��500��ʱ������ϵ��ͨ���ұ�������ϩ��������0.1x mol��ƽ�����ƶ�
C��550��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp��![]() �� p��
�� p��
D��550��ʱƽ����ϵ�б���ϩ�����������450��ʱ��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�������������ԭ��Ӧ���ǣ� ��
A.H2+Cl2=2HCl
B.2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
C.NH4HCO3![]() NH3��+CO2��+H2O
NH3��+CO2��+H2O
D.Zn+H2SO4=H2��+ZnSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Al��Cl2��Al2O3��HCl(aq)��A1(OH)3��NaOH(aq)�������ʣ�����֮������ͼ��ʾת����ϵ��ͼ��ÿ�������˵�����֮�䶼���Է�����Ӧ�������ƶ��в��������ǣ� ��
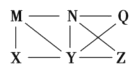
A. Nһ����HCl(aq)B. X������Al��Cl2
C. Q��Z�е�һ�ֱض�ΪA12O3D. Yһ��ΪNaOH(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ħ����[(NH4)2Fe(SO4)2��6H2O]��һ����Ҫ�Ļ���ԭ�ϣ���;�㷺����λͬѧ����������ʵ���Լ���Ħ������Һ�е�NH4+��Fe2+��SO42����
���������գ�
(1)��ͬѧ��������Һ�м���������Ba(OH)2��Һ���ȣ��ݳ���ʹ_______��ֽ�����������Լ���NH4+���ӣ�ͬʱ���ɰ�ɫ�������漴������Ϊ����ɫ��������_________ɫ��������_______��Һ������������������ܽ��Լ���Fe2+��SO42����
(2)��ͬѧ�������Fe2+�ķ���������������Һ�еμ�KSCN����Һ����ɫ���ټ�___________�Լ�����Һ��Ѫ��ɫ����Fe2+����ʵ�ʲ����У���ͬѧ��������Һ�м���KSCN������Һ���dz��ɫ��ԭ����________________��
��ͬѧ���ⶨijĦ������Ʒ��Fe2+�ĺ���������ȡ0.400g����Ʒ������ˮ����������ϡ�������0.0200mol/L��KMnO4��Һ�ζ�������KMnO4��Һ10.00mL��
��Ӧ�����ӷ���ʽΪ��5Fe2++MnO4��+8H+��Mn2++5Fe3++4H2O��
(3)�ζ��յ��������_______________________����Ʒ��Fe2+�İٷֺ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ca(OH)2��NaAlO2��NaOH���100.0mL�����Һ�������Һ��ͨ������CO2�����ɳ��������ʵ���n(����)����ͨ��CO2���������״���£�V(CO2)�Ĺ�ϵ����ͼ��ʾ������˵������ȷ���ǣ� ��
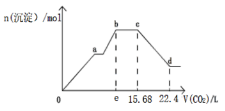
A. �����Һ��c(NaOH)+c(NaAlO2)=0.4mol/L
B. e���ֵΪ11.2
C. cd�α�ʾAl(OH)3�����ܽ�
D. bc�εĻ�ѧ��Ӧ����ʽΪ��NaOH+CO2=NaHCO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com