
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
【答案】(1)< (2)A C F(3)①0.08mol·L-1·min-1②600 ③400/21 ⑷正
【解析】
试题(1)由表中数据可知,温度越高SO2的转化率越低,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,即△H<0。
(2)A.该反应为气体分子数减少的可逆反应,对于反应前后体积变化的反应,容器内压强不再发生变化,说明反应达到平衡状态,A项正确;B.容器中气体的密度=m/V,反应前后质量守恒,反应在体积不变的容器中进行,所以气体的密度始终不变,密度不变不能说明反应达到平衡状态,B项错误;C.达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,反应混合物中,SO3的浓度不再改变,说明反应达到平衡状态,C项正确;D.浓度相等不能判断反应达到化学平衡状态,D项错误;E.应该是正逆反应速率之比等于化学计量数之比,才能作为判断是否达到化学平衡的依据,E项错误;F. v正(SO3): v逆(O2)=2:1,表明正逆反应速率相等是平衡状态,F项正确;答案选ACF。
(3)①经2min反应达到平衡后c(SO2)=0.08mol·L-1,反应的c(SO2)=(0.8mol÷2L)-0.08mol·L-1=0.32mol·L-1, v(SO2)="0.32mol/L÷2min=0.16" mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,则v(O2)= v(SO2)÷2=0.08mol·L-1·min-1。
②由①可知,反应的c(SO2)=0.32mol·L-1,则SO2的转化率为0.32mol/L÷0.4mol/L×100%=80.0%,对照表中数据可知温度为600℃。
③根据上述分析,平衡时,[SO3]=0.32mol/L,[SO2]=0.08mol/L,[O2]=1mol/L-0.16mol/L=0.84mol/L,则K=[SO3]2÷{[SO2]2×[O2]}=(0.32mol·L-1)2÷{[(0.08mol·L-1)2×0.84 mol·L-1]= 400/21 L·mol-1。
(4)根据增大压强,平衡向气体系数和减小的方向移动,即平衡正向移动。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
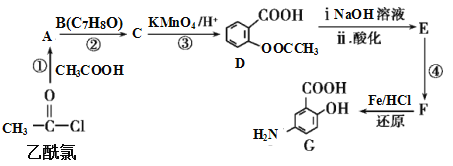
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如图:
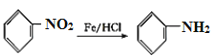
已知:
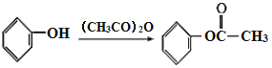 ,
,
(1)B的结构简式为_____。
(2)反应④的条件为____;①的反应类型为___;反应②的作用是____。
(3)下列对有机物G的性质推测正确的是____(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1mol G与足量NaHCO3溶液反应放出2mol CO2
(4)D与足量的NaOH溶液反应的化学方程式为_____。
(5)符合下列条件的C的同分异构体有___种。
A.属于芳香族化合物,且含有两个甲基 B.能发生银镜反应 C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是___(写出其中一种的结构简式)。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据题中的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)。_______
的流程图(无机试剂任选)。_______
合成路线流程图示例如图:X![]() Y
Y![]() Z…目标产物
Z…目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、含苯酚的工业废水的处理流程如图所示。
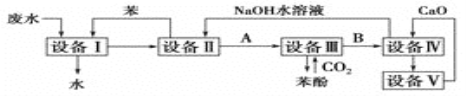
(1)①流程图设备Ⅰ中进行的是____操作(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②向设备Ⅱ加入NaOH溶液目的是________(填化学方程式),由设备Ⅱ进入设备Ⅲ的物质A是________(填化学式),由设备Ⅲ进入设备Ⅳ的物质B是________。
③在设备Ⅲ中发生反应的化学方程式为___________________________________。
④在设备Ⅳ中,CaO与水反应后的产物与B的水溶液反应的化学方程式为_____________。通过________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是________、________、________、和________。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______。
(3)从溶有乙醇的苯酚溶液中回收苯酚有下列操作①蒸馏②过滤③静置分液④加入足量的金属钠⑤通入过量的CO2气体⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液 ⑧加入硫酸与NaBr共热,合理的步骤是___________
Ⅱ.某化学兴趣小组的同学在乙醛溶液中加入溴水,溴水褪色。分析乙醛的结构和性质,同学们认为溴水褪色的原因有三种可能(请补充完整):
①溴在不饱和键上发生加成反应。
②溴与甲基上的氢原子发生取代反应。
③______________________。
为确定此反应的机理,同学们进行了如下探究:
(1)向反应后的溶液中加入硝酸银溶液,若有沉淀产生,则上述第________种可能被排除。
(2)有同学提出通过检测反应后溶液的酸碱性作进一步验证,就可确定该反应究竟是何种反应原理。此方案是否可行?________,理由是__________________________。
(3)若反应物Br2与生成物Br-的物质的量之比是1∶2,则乙醛与溴水反应的化学方程式为________________________。
(4)已知烯烃能发生如下反应: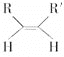
![]() RCHO+R′CHO请写出下列反应产物的结构简式:
RCHO+R′CHO请写出下列反应产物的结构简式:
![]() ___________________________________________;
___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
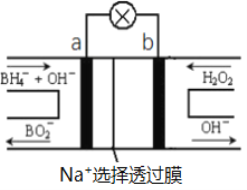
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)Z在元素周期表中的位置______________。
(2)X的最简单氢化物的电子式为______。
(3)Y单质与NaOH溶液反应的离子方程式为:________。工业生产Y单质的化学方程式为__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
(II)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
(CO中的化学键) | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(5)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是___;Y与氢元素形成的化合物的电子式是___。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是___;D与E能形成一种非极性分子,该分子的结构式为___;D所在族元素的氢化物中,沸点最低的是(填化学式)___。
(3)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3易水解。某同学设计用下图的装置制备少量的AlCl3固体。下列说法错误的是
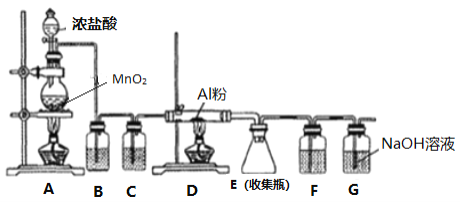
A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人D和E中
C. B中试剂为饱和碳酸氢钠溶液
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
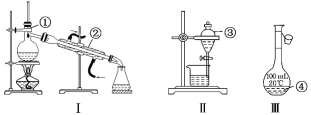
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
B. 1LpH =1的H2SO4溶液中所含的H+数目为0.2NA
C. 标准状况下,22.4L的辛烷完全燃烧生成的CO2分子数为8NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×109NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com